Дослід 1. Визначення металу за його еквівалентною массою
Для визначення металу по його еквівалентній масі використовують прилад, зображений на рис. 1.
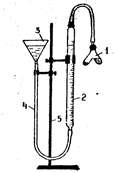 Перед початком досліду прилад, закріплений у штативі (5), випробують на герметичність. Для цього піднімають лійку (3) на деяку висоту, при цьому рівень води в бюретці (2) повинний фіксуватися на визначеному рівні. Якщо прилад герметичний, можна приступити до виконання досліду.
Перед початком досліду прилад, закріплений у штативі (5), випробують на герметичність. Для цього піднімають лійку (3) на деяку висоту, при цьому рівень води в бюретці (2) повинний фіксуватися на визначеному рівні. Якщо прилад герметичний, можна приступити до виконання досліду.
Рис. 1. Прилад для визначення еквівалентної маси металу
В один відросток склянки Оствальда (1) поміщають наважку металу (відомої маси і валентності).В інший відросток акуратно наливають 3-4 мл кислоти. Обережно з'єднують склянку Оствальда з бюреткою, щільно закривають пробкою і перевіряють герметичність приладу, як зазначено вище. Записують початковий рівень води в бюретці а1. Відлік роблять по нижньому меніску з точністю до 0,1 мл. Нахиливши склянку Оствальда, доливають кислоту до наважки металу. Спостерігають виділення водню і витиснення води з бюретки.
Після закінчення реакції дають склянці охолонути, щоб газ у приладі прийняв кімнатну температуру.
Приводять воду в бюретці і лійці, що з'єднані гумовою трубкою (4), до однакового рівня опусканням лійки, тобто скидають гідростатичний тиск. Записують рівень води в бюретці а2.
Обчислення:
Визначають об¢єм водню, що виділився 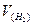 : = а2.- а1 (мл).
: = а2.- а1 (мл).
Визначають парціальний тиск водню: 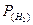 = Ратм – Р(
= Ратм – Р( 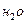 ) (мм рт ст.), де Р(
) (мм рт ст.), де Р( 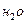 ) – тиск пара води при даній температурі (табличні дані).
) – тиск пара води при даній температурі (табличні дані).
Визначають температуру: Т = 273 + t0C. Приводять об¢єм водню до нормальних умов, користаючись об'єднаним газовим законом:
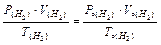 Þ
Þ 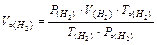 ;
; 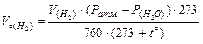 .
.
Обчислюють еквівалентну масу металу за законом еквівалентів:
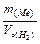 =
= 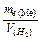 Þ
Þ 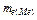 =
= 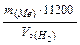 .
.
За валентністю металу розраховують атомну масу металу:
А(Ме) = mе (Ме) ×в
Використовуючи періодичну систему елементів Д.І. Менделєєва, розраховують теоретичне значення еквівалентної маси даного металу й обчислюють відносну погрішність експерименту: 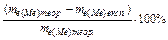 .
.
У висновках укажіть:
- Наважку якого металу ви досліджували?
- Які фактори впливають на величину помилки експерименту?
2.5. Список рекомендованої літератури
1. Глинка Н.Л. Общая химия. – Л.: Химия, 1988. – С.29-36; 2004. – С. 23-27.
2. Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 1985. – С. 7-9.
3. Фролов В.В. Химия. – М.: Высш. шк., 1986. – С. 12-14.
4. Пилипенко А.Г., Починок В.Я., Середа И.П. и др.Справочник по элементарной химии. – Киев.: Наук. думка, 1985. – С. 15-19.
5. Булавін В.І. Основи загальної хімії. – Харків.: ХДПУ, 1998. – С.7-9, 16-19.








