Т е м а 2. Закон еквівалентів
2.1. Рекомендації до вивчення теоретичного матеріалу
Закон еквівалентів експериментально встановлений німецьким хіміком В.Ріхтером (1797 р.) і сформульований Дж. Дальтоном (1803 р.): хімічні елементи і речовини взаємодіють між собою і утворюють нові речовини у кількостях, пропорційних їх еквівалентам. Математичний вираз закону еквівалентів: m1/m2 = Е1/Е2
Еквівалент речовини чи елемента – це реальна або умовна частинка речовини, яка взаємодіє з 1 моль атомів або іонів гідрогену або з ½ моль атомів оксигену. Наприклад, в НВr еквівалент брому становить 1 моль, тому що з 1моль атомів гідрогену з’єднується 1 моль атомів Вr. Еквівалент оксигену в Н2О дорівнює ½ моль, а нітрогену в NH3 - 1/3 моль . Числа 1, ½ і 1/3 називаються фактором еквівалентності (f).
Молярна маса еквівалента – маса 1 еквівалента, виражена в грамах (me) . Вона дорівнює добутку фактора еквівалентності та молярної маси речовини: me = f ·Mr . Еквівалентна маса гідрогену дорівнює 1г , його еквівалентний об’єм (Ve(H) ) становить 11,2 л. Для оксигену маємо відповідно 8 г/моль (маса еквівалента) і 5,6 л/моль (еквівалентний
об’єм, Vе(О) ) .
Таким чином, закон еквівалентів можна сформулювати так: маси речовин, що беруть участь і утворюються в реакції, відносяться між собою як їх молярні маси еквівалентів: m1/m2 = me(1)/me(2) . Якщо в рекції беруть участь газуваті речовини, розрахунки виконують за формулою: m/V = me/Ve .
Щоб вільно оперувати законом еквівалентів, необхідно навчитися розраховувати молярні маси еквівалентів елементів у сполуках і молярні маси еквівалентів складних речовин.
Молярна маса еквівалента елемента в сполуці чисельно дорівнює відношенню його молярної маси до ступеня окислення цього елемента в сполуці, узятого по модулю, чи до його валентності: mе = М/в.
Молярна маса еквівалента складної речовини дорівнює сумі молярних мас еквівалентів складових:
- для оксиду: mе оксиду = mе елемента + 8 або відношенню молярної маси оксиду до подвоєної кількості атомів кисню: mе оксиду = Моксиду/ 2 n;
- для кислоти: mе кислоти = mе кисл. залишку + 1 або відношенню молярної маси кислоти до її основності: mе кислоти = Мкислоти/ основність. Необхідно враховувати, що основність кислоти визначається по конкретній реакції. Наприклад:
Н2SO4 + NaOH ® NaHSO4 + H2O - основність кислоти в даній реакції дорівнює 1.
Н2SO4 + 2NaOH ® Na2SO4 + 2H2O - основність кислоти в даній реакції дорівнює 2;
- для основи: mе основи = mе металу + 17 або відношенню молярної маси основи до його кислотності: mе основи = Моснови/кислотність. Кислотність основи визначається за рівнянням реакції. Наприклад:
Cr(OH)3 + HCl ® Cr(OH)2Cl + H2O - кислотність гидроксиду хрому в даній реакції дорівнює 1;
- для солі: mе солі = mе катіону + mе аніону або відношенню молярної маси солі до добутку кількості іону (катіону чи аніону) на його заряд по модулю: mе солі = Мсолі/ n × z, де n – число катіонів (чи аніонів); z – заряд іону (по модулю).
2.2. Приклади розв ¢язування типових задач
Задача 1. Обчисліть еквівалентну масу металу і його оксиду, якщо в 0,42 г оксиду міститься 0,30 г цього металу.
Розв’язок. Знаходимо масу оксигену, що міститься в оксиді: m 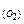 = m
= m 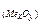 – m
– m 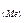 = 0,42 – 0,30 = 0,12 (г). Визначаємо еквівалентну масу металу за законом еквівалентів:
= 0,42 – 0,30 = 0,12 (г). Визначаємо еквівалентну масу металу за законом еквівалентів: 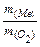 =
= 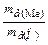 Þ
Þ 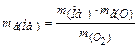 = 0,30×8:0,12 = =20 (г/моль).
= 0,30×8:0,12 = =20 (г/моль).
Еквівалентну масу оксиду металу розраховуємо за формулою:
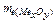 =
= 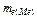 + 8 = 20 + 8 = 28 (г/моль).
+ 8 = 20 + 8 = 28 (г/моль).
Задача 2. Визначити еквівалентні маси металу і його оксиду, якщо 4,61 г цього металу витісняє з кислоти 0,375 г водню (н.у.).
Розв’язок. Відповідно до закону еквівалентів, 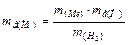 .
.
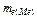 = 4,61×1:0,375 = 12,29 (г/моль).
= 4,61×1:0,375 = 12,29 (г/моль). 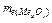 =
= 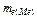 + 8 = 12,29 + 8 = 20,29 (г/моль).
+ 8 = 12,29 + 8 = 20,29 (г/моль).
Задача 3. Визначіть еквівалентну масу металу, якщо на утворення 2,72 г його оксиду потрібно 0,328 л О2, що знаходиться при температурі 270С и тиску 303,9 кПа.
Розв’язок. Спочатку знайдемо масу кисню, використовуючи рівняння Клапейрона-Менделєєва: 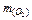 =
= 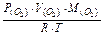 = (303,9×0,328×32):(8,31×300) = 1,28 (г).
= (303,9×0,328×32):(8,31×300) = 1,28 (г).
Далі визначаємо масу металу: 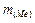 =
= 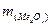 -
- 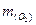 = 2,72 - 1,28 = 1,44 (г).
= 2,72 - 1,28 = 1,44 (г).
Еквівалентні маси металу й оксиду розрахуємо як і в попередньому прикладі: 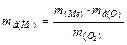 = 1,44 × 8:1,28 = 9 (г/моль);
= 1,44 × 8:1,28 = 9 (г/моль);
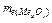 =
= 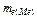 + 8 = 9 + 8 = 17 (г/моль).
+ 8 = 9 + 8 = 17 (г/моль).
Задача 4. Обчисліть еквівалентну масу хлору в його оксиді, який містить 61,2% оксигену. Яку формулу має оксид ?.
Розв’язок. Знайдемо вміст хлору в оксиді: 100 – 61,2 = 38,8 (%). Користуючись законом еквівалентів, запишемо:
m(Cl) / m(O2) = me(Cl) / me(O) , або: me(Cl) = m(Cl)·8 / m(O2) = (38,8·8)/61,2 = 5,07 г/моль-екв.
Маса еквівалента хлору дорівнює відношенню молярної (атомної) маси хлору до його валентності: me(Cl) = Ar(Cl)/B .
Отже: в = Ar(Cl) : me(Cl) = 35,45 : 5,07 = 7 .
Формула оксида Сl2O7 .
2.3. Задачі для самостійного рішення: 1, 10, 38
2.4. Лабораторна робота
Необхідні прилади, обладнання і реактиви: прилад для визначення еквівалента металу, термометр, барометр, наважки металу, розчин хлоридної (соляної) кислоти (1:1,5), бюретка для титрування на 50 мл, наважки карбонатів, гідрокарбонатів, гидроксидів натрію, калію, амонію, 0,1 н. розчин хлоридної(соляної) кислоти, колби для титрування, бюретка, індикатор (метилоранж).








