Тема 1.1 « Основные законы идеальных газов »
20.02.02. ОП.03. Раздел 1. « Термодинамика »
Тема 1.1 « Основные законы идеальных газов »
Занятие №2. Тема: « Уравнение состояния идеального газа. Законы идеального газа »
Уравнение состояния идеального газа . Хотя в природе идеальных газов нет и модель «идеального газа» лишь приближенно отражает свойства реальных газов, тем не менее изучение законов идеального газа помогает определять поведение реального газа в определенных условиях. Расхождение свойств реального и идеального газов зависит от условий, в которых находится газ. Чем меньше значение давления р и больше температура Т, тем ближе свойства идеального и реального газов. Все газовые законы формулируются для идеальных газов.
Опыт и теория показывают, что параметры р, Т и v, характеризующие состояние идеального газа, не являются независимыми. В равновесном состоянии системы они взаимосвязаны следующими уравнениями:
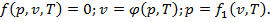
Равновесное состояние тела — это такое состояние, при котором во всех точках тела v, p и Т и все другие физические параметры одинаковы.
В молекулярно-кинетической теории газов, основные элементы которой разработал М.В. Ломоносов, доказано, что давление газа можно определить по формуле
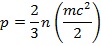
где п — число молекул в единице объема; т — масса молекулы; с2 — средняя квадратичная скорость поступательного движения молекул.
Кинетическая энергия газа пропорциональна абсолютной температуре Т:
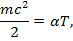
где α — коэффициент пропорциональности. Из данных формул следует:
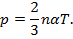
Умножая обе части донорного уравнения на заданный объем V, получаем
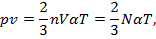
где N = nV — число молекул в заданном объеме.
Получение уравнение является основным уравнением кинетической теории газов.
Разделив последнее выражение на массу газа М в заданном объеме V, имеем
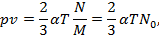
где v = V / M — удельный объем, м3/кг; N0 = N / M— число молекул в 1 кг газа.
Обозначая 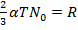 , получаем уравнение состояния для 1 кг газа:
, получаем уравнение состояния для 1 кг газа:
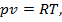
где R — удельная газовая постоянная, Дж/(кг∙К).
Для произвольной массы М газа справедливо уравнение Клапейрона — термическое уравнение состояния идеального газа или характеристическое уравнение:
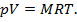
Моль — количество вещества, в котором содержится столько же структурных элементов (атомов, молекул и т. д.) сколько атомов содержится в углероде массой 0,012 кг.
В системе СИ за единицу количества вещества принимается 1 моль.
Молярной массой μ называется масса 1 моль
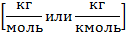
Например, если относительная молекулярная масса О2 составляет 32, то молярная масса О2 будет равна μ = 32 кг/кмоль = 0,032 кг/моль.
Молярный объем Vμ — объем 1 моль при нормальных условиях (р = 760 мм рт. ст. ∙ 105 Па, t = 0 °С).
Для всех газов объем 1 моль составляет Vμ = 2,24∙10-2 м3/моль.
Закон Авагадро: в одном моле вещества содержится одно и тоже число атомов или молекул: N А = 6,02∙1023 моль-1.
Запишем уравнение состояния ( 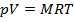 ) для 1 моль газа и получим уравнение Менделеева-Клапейрона:
) для 1 моль газа и получим уравнение Менделеева-Клапейрона:
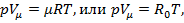
где R0 = μR — универсальная газовая постоянная.
Универсальная газовая постоянная R0 есть работа 1 моль идеального газа в процессе при постоянном давлении и изменении его температуры на 1°:
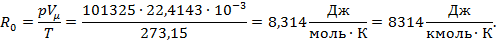
Газовую постоянную R для любого газа можно определить из выражения
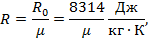
где р измеряется в кг/кмоль.
Законы идеального газа . Законы идеального газа можно вывести из уравнения Клапейрона ( 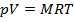 ).
).
Запишем уравнение Клапейрона для начального и конечного состояний газа:
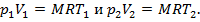
Разделив почленно первое уравнение на второе, получим:
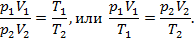
Для изотермического процесса, т. е. процесса, протекающего при постоянной температуре T = const, вычеркиваем из последнего уравнения члены Т1, и Т2 и получаем закон Бойля-Мариотта:
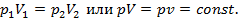
Для изобарного процесса, т. е. процесса, протекающего при постоянном давлении р = const, сокращая исходное уравнение на p, получаем закон Гей-Люсака:
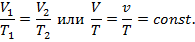
Для изохорного процесса, т. е. процесса, протекающего при постоянном объеме V- const, сокращая исходное уравнение на V, получаем закон Шарля:
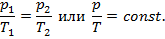
Для адиабатного процесса, т. е. процесса, протекающего без подвода и отвода теплоты Q , можно записать следующее выражение:
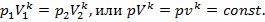
где k — показатель адиабаты (будет рассмотрен ниже).
Вопросы и задания:
1. Что помогает определять изучение законов идеального газа?
2. При каком условии свойства идеального ближе к свойствам реального газов?
3**. Как взаимосвязаны параметры р, Т и v?
4. Какое состояние тела является равновесным?
5*. Что доказано в молекулярно-кинетической теорией газов? Напишите формулу с названием ее составляющих.
6. Выполните таблицу следующей формы:








