Выведем уравнение зависимости скорости обезуглероживания от расхода аргона qAr , м3/(т×мин) (индекс р в указывает, что скорость обезуглероживания обусловлена разбавлением СО).
Если за время Dt в расплав ввести DQAr (м3/т) аргона, то окислится D[% С] углерода и выделится соответствующий объем СО (DQСО). Давление СО в отходящих газах
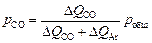 , (9.3)
, (9.3)
где pобщ - общее давление газовой фазы, равное в условиях открытой плавки 1 атм.
Величина DQСО (м3/т) связана с D[С] балансовым соотношением
DQСО = -D[С]×10×22,4/12 = 18,66(-D[С]). (9.4)
Подставим уравнение (9.4) в формулу (9.3) и выразим D[С] через pCO , которое будем считать равным равновесному давлению СО (обозначим его 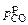 ),
),
D[С] = -QAr 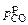 /[18,66(1 -
/[18,66(1 - 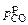 )], (9.5)
)], (9.5)
где
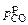 = K[C]fC /[Cr]3/4. (9.6)
= K[C]fC /[Cr]3/4. (9.6)
Минус в уравнении (9.5) указывает на снижение концентрации углерода. Абсолютное значение (модуль) скорости обезуглероживания
D[С]/Dt = 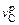 = qAr
= qAr 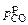 /[18,66 (1 -
/[18,66 (1 - 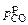 )]. (9.7)
)]. (9.7)
Наряду с окислением углерода 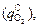 кислород расходуется также на окисление хрома
кислород расходуется также на окисление хрома 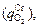 железа
железа 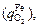 кремния
кремния 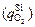 . В общем случае
. В общем случае
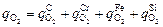 . (9.8)
. (9.8)
Из анализа реальных условий продувки следует [60], что кислород на окисление элементов распределяется следующим образом: железо - 15 %, кремний (при [Si] > 0,06 %) - 68 %, углерод и хром - остальное. Тогда
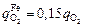 ; (9.9)
; (9.9)
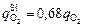 (при [Si] > 0,06 %). (9.10)
(при [Si] > 0,06 %). (9.10)
Скорости окисления (%/мин) железа до FеО и кремния до SiO2 соответственно равны
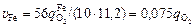 ; (9.11)
; (9.11)
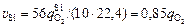 . (9.12)
. (9.12)
При [Si] £ 0,06 % 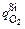 = 0 и υSi = 0.
= 0 и υSi = 0.
Тогда 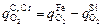 в зависимости от содержания кремния равно
в зависимости от содержания кремния равно
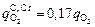 при [Si] > 0,06 %; (9.13)
при [Si] > 0,06 %; (9.13)
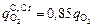 при [Si] £ 0,06 %. (9.14)
при [Si] £ 0,06 %. (9.14)
Распределение 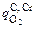 между углеродом и хромом определяется величиной
между углеродом и хромом определяется величиной 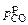 . Если
. Если 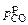 > 1 атм, то хром не окисляется, а полностью восстанавливается по реакции (9.1). Тогда υCr = 0 и весь кислород
> 1 атм, то хром не окисляется, а полностью восстанавливается по реакции (9.1). Тогда υCr = 0 и весь кислород 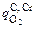 расходуется на окисление углерода (т.е.
расходуется на окисление углерода (т.е. 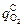 =
= 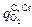 ) со скоростью
) со скоростью
υC = 12 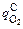 /(10×11,2) =
/(10×11,2) = 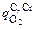 /9,33. (9.15)
/9,33. (9.15)
При 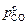 < 1 атм и избытке кислорода (
< 1 атм и избытке кислорода ( 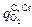 > 9,33
> 9,33 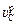 ) хром окисляется до Сr3O4 со скоростью
) хром окисляется до Сr3O4 со скоростью
υCr = 3×52 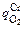 /(10×2×22,4) = 0,3545(
/(10×2×22,4) = 0,3545( 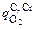 - 9,33
- 9,33 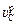 ). (9.16)
). (9.16)
При недостатке кислорода ( 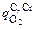 £ 9,33
£ 9,33 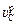 ) скорость обезуглероживания определяется уравнением (9.15), а υCr = 0.
) скорость обезуглероживания определяется уравнением (9.15), а υCr = 0.
Изменение температуры ванны во времени можно получить из выражения мгновенного теплового баланса процесса для всей массы металла т (кг)
SDHi = DHг + DHMe + DHт.п , (9.17)
где DHi = mυ i hi /100 % - количество тепла (кДж), выделяющееся в единицу времени в результате окисления i-го элемента (С, Сr, Fe, Si) со скоростью υ i (%/мин) при удельном тепловом эффекте hi (кДж/кг); DHг , DHMe , DHт.п - количество тепла, расходующееся соответственно на нагрев рафинирующей газовой смеси, металла и компенсацию тепловых потерь. Для аргоно-кислородной смеси
DHг = (CАr qАr m×10-3 + CO2qO2 m×10-3(T – Tг). (9.18)
Величину DHMe выразим через скорость нагрева металла υ T
DHMe = CMemυT. (9.19)
Величина
DHт.п = CMemw, (9.20)
где w - параметр, характеризующий скорость охлаждения металла в результате тепловых потерь, К/мин, зависит от вместимости конвертера [60].
Для 45-т конвертера w = 2–4 К/мин, для 10-т w = 6–7 К/мин, для
5-т плавок w = 12–14 К/мин. Оценить значение w для конвертера другой вместимости можно по интерполяционному уравнению
w = 50/m + 2. (9.21)
Подставив уравнения (9.18) – (9.20) в выражение (9.17) и проведя необходимые преобразования, получаем
υ T = [0,01Shi υ i - (T – Tг)(CАr qАr + CO2qO2)10-3 - CMew]/CMe . (9.22)
Теперь, если в момент времени tn известен состав ([С]n , [Сr]n , [Si]n) и температура Т металла, а также скорости υC , υCr , υSi , υFe и υ T, то для момента времени tn + 1 = tn + Dt состав и температура равны
[C]n + 1 = [C]n + υC Dt; (9.23)
[Cr]n + 1 = [Cr]n + υCr Dt; (9.24)
[Si]n + 1 = [Si]n + υSi Dt; (9.25)
T n + 1 = T n + υ T Dt. (9.26)
Величина Dt должна быть достаточно малой, чтобы υ i в течение Dt можно было считать постоянными.
Решение. Расчеты проводим по следующей схеме. Зная состав металла, температуру, режим продувки в момент времени t, определяем скорости окисления элементов и изменения температуры. Затем вычисляем состав и температуру металла в заданное время t + Dt.
1. Расчет скоростей окисления элементов при [Si] > 0,06 %.
При t = 0 по формулам (9.11) – (9.13) определим:
υFe = 0,075×0,52 = 0,039 %/мин;
υSi = 0,085×0,52 = 0,0442 %/мин;
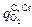 = 0,17×0,52 = 0,0884 м3/(т×мин).
= 0,17×0,52 = 0,0884 м3/(т×мин).
Вычислим по уравнению (9.2) значение K при 1748 К:
lgK = (-11520/1748) + 7,64 = 1,05; K = 11,22.
Определим fC при 1873 К:
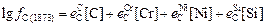 =
=
= 0,14×1,16 - 0,024×17,29 + 0,012×10 + 0,08×0,4 = -0,10056.
Значение fC при 1748 К определим с помощью выражения ТКР [3] (см. задачу 61):
lg fC = 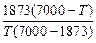 lg fC (1873); fC (1748) = 0,7755.
lg fC (1873); fC (1748) = 0,7755.
Тогда по уравнению (9.6) получим
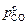 = 11,22×1,16 - 0,7755/(17,29)0,75 = 1,19 атм.
= 11,22×1,16 - 0,7755/(17,29)0,75 = 1,19 атм.
Поскольку 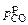 > 1 атм, то кислород
> 1 атм, то кислород 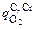 расходуется на окисление углерода и в соответствии с уравнением (9.15)
расходуется на окисление углерода и в соответствии с уравнением (9.15)
υC = 0,0884/9,33 = 0,009475 %/мин, υCr = 0.
2. Расчет скорости нагрева.
Вычислим величину υ T по формуле (9.22):
υ T = [0,01(hC υC + hCr υCr + hSi υSi + hFe υFe) - (T - Tг)(CАr qАr +
+ CO2qO2)10-3 - CMew]/CMe == [0,01 (11100×0,009475 + 9570×0 +
+ 25400×0,0442 + 4000×0,039) - (1748 - 298) (0,928×0,18 +
+ 1,545×0,52)×10-3 - 0,838×3]/0,838 = 11,8353 К/мин.
3. Расчет состава и температуры металла.
Принимаем Dt1 = 1 мин и по формулам (9.23) – (9.26) определяем состав и температуру металла через промежуток времени Dt1:
[С]1 = 1,16 - 0,009475×1 = 1,150525 %;
[Cr]1 = 17,27 - 0×1 = 17,27 %;
[Si]1 = 0,4 - 0,0442×1 = 0,3558 %;
T1 = 1748 + 11,8353 = 1759,835 К.
Приняв в качестве исходных величин результаты по составу и температуре, полученные через Dt1 можно повторить расчет для следующего промежутка времени Dt2 и т.д. Значения концентраций [С], [Cr], [Si] и температуры T приведены в таблице, из которой видно, что после восьми минут продувки кремний окисляется до 0,046 %, т.е. до [Si] < 0,06 %, поэтому в дальнейшем υSi = 0, a υС имеет повышенные значения. До конца первого периода 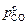 > 1 атм и величина υС определяется только расходом кислорода
> 1 атм и величина υС определяется только расходом кислорода 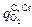 . К началу второго периода (23-я минута продувки)
. К началу второго периода (23-я минута продувки) 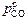 < 1 атм. Дальнейшее обезуглероживание возможно лишь при разбавлении СО аргоном. С этой целью qAr повышают до 0,25 м3/(т×мин). Это позволяет обеспечить высокие значения
< 1 атм. Дальнейшее обезуглероживание возможно лишь при разбавлении СО аргоном. С этой целью qAr повышают до 0,25 м3/(т×мин). Это позволяет обеспечить высокие значения 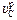 (0,138 и 0,056 %/мин в конце 23-й и 24-й минут соответственно), однако в связи с недостатком кислорода (
(0,138 и 0,056 %/мин в конце 23-й и 24-й минут соответственно), однако в связи с недостатком кислорода ( 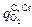 <
<
< 9,33 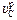 ) фактическая скорость обезуглероживания υС <
) фактическая скорость обезуглероживания υС < 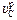 и равна
и равна
υС = 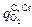 /19,33, а υСr = 0. В конце 25-й минуты появляется избыток кислорода (
/19,33, а υСr = 0. В конце 25-й минуты появляется избыток кислорода ( 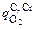 > 9,33
> 9,33 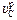 ) и начинает окисляться хром (υСr ¹ 0). Такой режим сохраняется до конца продувки. Рассчитаем изменение состава и температуры металла после 26-й минуты продувки. К концу 25-й минуты металл содержал 0,982 % С, 17,29 % Сr, 0,046 % Si,
) и начинает окисляться хром (υСr ¹ 0). Такой режим сохраняется до конца продувки. Рассчитаем изменение состава и температуры металла после 26-й минуты продувки. К концу 25-й минуты металл содержал 0,982 % С, 17,29 % Сr, 0,046 % Si,
T = 1898,16 К.
4. Расчет скоростей окисления элементов при [Si] £ 0,06 %.
По формуле (9.11) υFe = 0,075×0,5 = 0,0375 » 0,038 %/мин. Концентрация [Si] < 0,06 %, поэтому υSi = 0 и 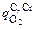 , вычисленная по формуле (9.14), равна qO2 = 0,85×0,5 = 0,425 м3/(т×мин).
, вычисленная по формуле (9.14), равна qO2 = 0,85×0,5 = 0,425 м3/(т×мин).
Величина 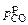 , определенная по формуле (9.6) при 1898,16 К (fC = 0,566; K = 37,236, см. ранее приведенный пример), равна
, определенная по формуле (9.6) при 1898,16 К (fC = 0,566; K = 37,236, см. ранее приведенный пример), равна 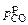 = 0,700 атм. Тогда по уравнению (9.7) получим
= 0,700 атм. Тогда по уравнению (9.7) получим 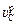 = 0,25×0,700/[18,66(1 - 0,700)] »
= 0,25×0,700/[18,66(1 - 0,700)] »
» 0,0313 %/мин.
Величина 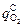 , необходимая для обеспечения
, необходимая для обеспечения 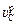 , равна
, равна
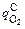 = 9,33 × 0,0313 = 0,292 м3/(т×мин), т.е.
= 9,33 × 0,0313 = 0,292 м3/(т×мин), т.е. 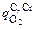 >
> 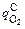 и υC =
и υC = 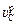 = = 0,0313 %/мин, а избыток кислорода окисляет хром. По формуле (9.16) υCr = 0,3545 × (0,425 - 9,33×0,0313) » 0,047 %/мин.
= = 0,0313 %/мин, а избыток кислорода окисляет хром. По формуле (9.16) υCr = 0,3545 × (0,425 - 9,33×0,0313) » 0,047 %/мин.
5. Скорость нагрева υ T рассчитываем по формуле (9.22):
υ T = [0,01(hC υC + hCr υCr + hSi υSi + hFe υFe) - (T - Tг)(CАr qАr +
+ CO2qO2)10-3 - CMew]/CMe = [0,01(11100×0,0313 + 9570×0,047 +
+ 25400×0 + 4000×0,038) - (1898,16 - 298) (0,928×0,25 +
+ 1,545×0,52)×10-3 - 0,838×3]/0,838 = 6,38 К/мин.
6. Расчет состава и температуры металла.
Расчет ведем по формулам (9.23) – (9.26) при Dt = 1 мин:
[С] = 0,282 - 0,0313×1 » 0,251 %;
[Cr] = 17,29 - 0,047×1 » 17,24 %;
[Si] = 0,046 - 0×1 = 0,046 %;
Т = 1898,16 + 6,38×1 = 1904,54 К.








