Исходные данные. 1. Температура расплава 1873 К. 2. Экспериментальные данные об изменении активности кислорода в стали приведены в таблице
| [Аl], % | aO | [Аl], % | aO |
| 0,001 | 0,00204 | 0,092 | 0,00010 |
| 0,002 | 0,00105 | 0,220 | 0,00006 |
| 0,004 | 0,00079 | 0,305 | 0,00005 |
| 0,010 | 0,00050 | 0,450 | 0,00004 |
| 0,050 | 0,00021 | 0,730 | 0,00002 |
3. 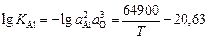 .
.
Теория. Кривой раскисления называют графическую зависимость изменения концентрации растворенного в стали кислорода от содержания раскислителя. Связь между концентрацией растворенного кислорода и его активностью выражается известным соотношением
[О] = aO/fО или lg[O] = lg aO/fО . (7.24)
Согласно Вагнеру, с учетом параметров взаимодействия только первого порядка
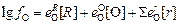 , (7.25)
, (7.25)
где [R] и [r] - концентрации раскислителя и легирующего элемента соответственно.
Подставив выражение (7.25) в уравнение (7.24) и решив его относительно [О] для различных [R], можно построить кривую раскисления. В первом приближении, с учетом того, что [О] в большинстве случаев много меньше [R] и [r], получим
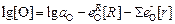 . (7.26)
. (7.26)
Решение. Подставив экспериментальные данные в уравнение (7.26) и приняв во внимание, что основным легирующим элементом в исследуемой марке стали является хром (17 %), получим кривую зависимости [О] от [R], представленную на рисунке (кривая 1). Видно, что на кривой раскисления имеется минимум [O]min = 0,001 %, соответствующий концентрации растворенного алюминия ~ 0,1 %. Такой ход кривой раскисления объясняется сложным характером зависимости [О] от [R]. В случае образования Al2O3
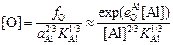 , (7.27)
, (7.27)
где КAl - константа реакции раскисления.
При этом активность кислорода с увеличением содержания алюминия монотонно снижается (кривая 2 на рисунке) в соответствии с уравнением
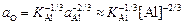 . (7.28)
. (7.28)
Примечания. 1. Отметим, что минимальную концентрацию кислорода, вычисленную описанным способом, нельзя считать оптимальной для практики. Обычно для раскисления оказываются достаточными значительно меньшие концентрации алюминия.
2. Аналитическое выражение для расчета концентрации раскислителя [R]*, соответствующей минимальному содержанию кислорода в низколегированной стали в равновесии с оксидом R mОn, имеет вид [47]
[R]* = 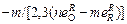 . (7.29)
. (7.29)
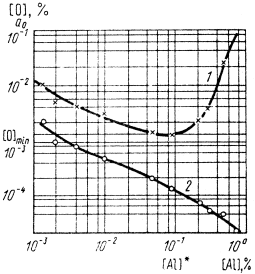
Кривые раскисления (1 ) и изменения aO (2 ) в стали 12Х17
Минимальную концентрацию кислорода [О]min можно вычислить по уравнению
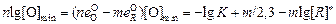 . (7.30)
. (7.30)
3. При высоких концентрациях в стали легирующего элемента r, который является значительно более слабым раскислителем, чем R (например, хром и алюминий), т.е. когда образуются продукты раскисления типа R mOn , выражение (7.25) преобразуется:
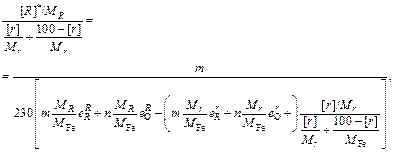 (7.31)
(7.31)
где M j - атомные массы компонентов стали.
Минимальную концентрацию кислорода [О]min можно в этом случае найти по уравнению
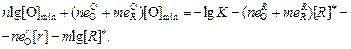 (7.32)
(7.32)
По формуле (7.31) с учетом того, что основным легирующим элементом r в стали 12Х17 является хром, концентрация алюминия [Аl]*, обеспечивающая минимальное содержание растворенного кислорода в стали, равна 0,08 %, что близко к значению 0,1 %, полученному из экспериментальных данных по измерению aO .
Уравнение (7.32) не имеет аналитического решения, поэтому для оценочных расчетов, с учетом, что [О]min << 1, можно использовать приближенное выражение
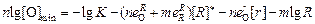 . (7.33)
. (7.33)
В рассматриваемом случае (lg КAl = 14) расчет по формуле (7.33) дает [О]min = 10-3 %, что совпадает с полученным ранее значением на кривой раскисления.
При использовании уравнений (7.29) и (7.30) значения [А1]* и [О]min оказываются равными соответственно 0,08 и 2×10-4 %, т.е. для таких сильных раскислителей, как алюминий 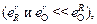 расчеты [R]* по формулам (7.29) и (7.31) дают практически одинаковые результаты, близкие к экспериментальным данным. Однако при определении [О]min в легированных сталях необходимо применять уравнение (7.32), в котором, в отличие от выражения (7.30), учитывается влияние легирующего элемента R на величину fO .
расчеты [R]* по формулам (7.29) и (7.31) дают практически одинаковые результаты, близкие к экспериментальным данным. Однако при определении [О]min в легированных сталях необходимо применять уравнение (7.32), в котором, в отличие от выражения (7.30), учитывается влияние легирующего элемента R на величину fO .
70. Условия окисления жидких железа, никеля
и кобальта
Задача. Определить давление кислорода, соответствующее окислению железа, никеля и кобальта, и равновесную с оксидом концентрацию кислорода в металле. Оценить возможность рафинирования этих металлов от кислорода в результате прямого удаления его в газовую фазу в условиях вакуумной плавки.
Исходные данные. Температура 1923 К.
[О](1 % в Fe) + Fe(ж) = FeO(ж) ; 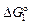 = -121000 + 52,38T, Дж; (7.34)
= -121000 + 52,38T, Дж; (7.34)
[О](1 % в Co) + Co(ж) = CoO(т) ; 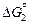 = -181322 + 84,88T Дж; (7.35)
= -181322 + 84,88T Дж; (7.35)
[О](1 % в Ni) + Ni(ж) = NiO(т) ; 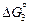 = -181100 + 92,82T Дж; (7.36)
= -181100 + 92,82T Дж; (7.36)
 O2 (г) = [O](1 % в Fe) ;
O2 (г) = [O](1 % в Fe) ; 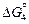 = -117200 - 2,89Т Дж; (7.37)
= -117200 - 2,89Т Дж; (7.37)
 O2 (г) = [О](1 % в Co) ;
O2 (г) = [О](1 % в Co) ; 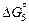 = -62910 -7,87T Дж; (7.38)
= -62910 -7,87T Дж; (7.38)
 O2 (г) = [О](1 % в Ni) ;
O2 (г) = [О](1 % в Ni) ; 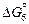 = -71600 + 1,84T Дж. (7.39)
= -71600 + 1,84T Дж. (7.39)
Теория. Растворение кислорода в жидких железе, кобальте и никеле сопровождается диссоциацией молекул О2 на атомы (или одноатомные ионы). Выражения констант равновесия этих процессов (7.37) – (7.39) имеют вид
K4–6 = 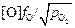 . (7.40)
. (7.40)
Видно, что при заданной температуре (а следовательно, заданной K4–6) активность кислорода [О] в жидких железе, кобальте и никеле изменяется прямо пропорционально квадратному корню из давления кислорода в газовой фазе: [О] = (K4–6 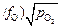 . При некоторой предельной концентрации кислорода [О]max по реакциям (7.34) – (7.36) образуется оксид соответствующего металла, и число фаз Ф в системе возрастает с двух (жидкий металл и газообразный кислород) до трех (металл с концентрацией кислорода [О]max, газообразный кислород и жидкий (или твердый) оксид. При этом число степеней свободы с в системе уменьшится с 1 до 0 (нонвариантное равновесие): с = k - Ф + 1 = 0, где k = 2 - число компонентов (металл и кислород); 1 - количество произвольно (свободно) задаваемых параметров (в рассматриваемом случае рO2 ). Равенство с = 0 означает, что нельзя изменить ни одного параметра системы (температура Т, [О] и рO2 ) без изменения числа фаз.
. При некоторой предельной концентрации кислорода [О]max по реакциям (7.34) – (7.36) образуется оксид соответствующего металла, и число фаз Ф в системе возрастает с двух (жидкий металл и газообразный кислород) до трех (металл с концентрацией кислорода [О]max, газообразный кислород и жидкий (или твердый) оксид. При этом число степеней свободы с в системе уменьшится с 1 до 0 (нонвариантное равновесие): с = k - Ф + 1 = 0, где k = 2 - число компонентов (металл и кислород); 1 - количество произвольно (свободно) задаваемых параметров (в рассматриваемом случае рO2 ). Равенство с = 0 означает, что нельзя изменить ни одного параметра системы (температура Т, [О] и рO2 ) без изменения числа фаз.
Таким образом, при трехфазном равновесии заданной температуре соответствует определенное значение рO2 и [О] = [О]max, при которых образуется оксид. Значение предельной растворимости кислорода [О]max определим из выражений констант равновесия реакций (7.34) – (7.36):
K1–3 = aMеО/([О]max fОaMe).
Поскольку металл и оксид металла МеО - чистые вещества (содержанием кислорода в металле пренебрегаем), то их активности равны: aMe = 1 и aMeO = 1. Коэффициент fО в никеле и кобальте по данным [3, 48] близок к 1 в довольно широком интервале концентраций кислорода. Для железа lgfО(1873) = -0,2[О] [3]. Для практических расчетов fО в железе также можно принять равным 1. Тогда
[О]max = 1/(K1–3fО); (7.41)
lg[О]max = -(lg K1–3 + lg fО). (7.42)
Давление кислорода, соответствующее [О]max, определим по уравнению (7.40):
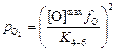 . (7.43)
. (7.43)
Решение. Вычислим K1–3 для железа, кобальта и никеля при 1923 К:
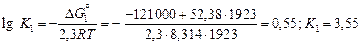 .
.
Значения K2 и K3 соответственно равны 3,11 и 1,17. Предельную растворимость кислорода в железе, кобальте и никеле вычислим по формуле (7.41):
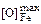 = 1/(3,55×1) = 0,28 %;
= 1/(3,55×1) = 0,28 %; 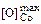 = 0,32 %;
= 0,32 %; 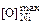 = 0,85 %.
= 0,85 %.
Значения констант равновесия процессов (7.34) – (7.39) следующие:
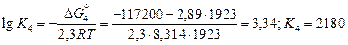 .
.
Аналогично найдем K5 = 132 и K6 = 71.
По уравнению (7.43) определяем рO2 , соответствующее при 1923 К [О]max образованию оксида железа:
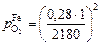 » 1,6×10-8 атм » 1,6×10-3 Па.
» 1,6×10-8 атм » 1,6×10-3 Па.
Аналогично для кобальта и никеля получим
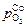 = 5,9×10-6 атм » 0,60 Па и
= 5,9×10-6 атм » 0,60 Па и 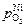 = 1,4×10-4 атм » 14 Па.
= 1,4×10-4 атм » 14 Па.
Полученные результаты можно использовать для оценки возможности прямой десорбции кислорода из металла в газовую фазу в условиях вакуумной плавки. В промышленных вакуумных агрегатах общее давление обычно составляет 0,1–1 Па. Примем давление кислорода в газовой фазе печи равным общему давлению. Видно, что только для никеля 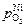 = 14 Па, соответствующее предельной растворимости кислорода [О]max, выше обычного остаточного давления 0,1–1 Па. Следовательно, удаление кислорода непосредственно в газовую фазу возможно только из расплавов никеля, а из расплавов железа и кобальта невозможно.
= 14 Па, соответствующее предельной растворимости кислорода [О]max, выше обычного остаточного давления 0,1–1 Па. Следовательно, удаление кислорода непосредственно в газовую фазу возможно только из расплавов никеля, а из расплавов железа и кобальта невозможно.








