Исходные данные. 1. Состав металла: 0,20 % С; 0,04 % Cr; 2 % Ni; 0,04 % Р. 2. Состав шлака: 45 % CaO; 20 % SiO2; 16 % FeO; 7 % MnO; 7 % MgO; 5 % А12O3; 0,05 % P2O5.
Теория. Рафинирование стали от фосфора обычно осуществляют путем его окисления (например, по реакции (2.79)) и перевода образующегося оксида фосфора в шлак:
[Р] + 2,5 [О] = (PO2,5 ). (2.79)
В результате обработки большого массива экспериментальных данных по распределению фосфора между металлом и шлаком получено уравнение
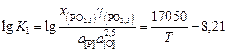 . (2.80)
. (2.80)
Обычно уравнение дефосфорации записывают с участием CaO. В рассматриваемом случае содержание CaO влияет на величину gPO2,5 . Из уравнения (2.80) следует, что полнота дефосфорации повышается при понижении температуры, увеличении окисленности системы металл–шлак a[O] и снижении активности продукта реакции РO2,5 в шлаке. Снижение a(PO2,5) достигается введением СаО. Если активность кислорода в металле определяется оксидом железа в шлаке, то согласно данным [3]:
(FeO) = [О] + Fe(ж) ; (2.81)
lg К3 = -6372 / Т + 2,73 (2.82)
и реакцию окисления фосфора удобно записать в виде суммарной реакции
[Р] + 2,5(FeO) = (PO2,5 ) + 2,5Fe(ж) ; (2.83)
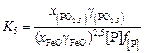 ; (2.84)
; (2.84)
lg K5 = lg K1 + 2,5lg К3 = 1120/T - 1,385. (2.85)
Выразим xPO2,5 через концентрацию фосфора в шлаке (% Р):
xPO2,5 = (% Р)/(31Sn), (2.86)
где 31 - атомная масса фосфора; Sn - сумма молей компонентов шлака в 100 г.
Подставим формулу (2.86) в уравнение (2.84), после преобразований получим выражение для коэффициента распределения фосфора между металлом и шлаком:
L = (% Р)/[% Р] = 31K5 fP(xFeO gFeO )2,5 Sn/gPO2,5 . (2.87)
Значения gFeO и gPO2,5 будем вычислять по теории регулярных ионных растворов, используя соответствующие формулы В.А. Кожеурова [18] (см. задачу 23):
lg gFeO » lg g(Fe) =
= 1000T -1 [2,18xMn xSi + 5,9(xCa + xMg )xSi + 10,5xCa хP ]; (2.88)
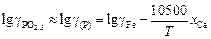 , (2.89)
, (2.89)
где хMn , хSi , хCa , хMg , хP - ионные доли соответствующих катионов в шлаке 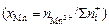 .
.
Зная L, можно найти конечную концентрацию фосфора в металле [Р]к и шлаке (Р)к . Для этого составим и решим систему уравнений
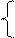 Lк = (Р)к /[Р]к; (2.90)
Lк = (Р)к /[Р]к; (2.90)
mм [Р]н + mш (Р)н = mм [Р]к + mш (Р)к, (2.91)
где тм и mш - масса металла и шлака; [Р]н и (Р)н - начальные концентрации фосфора в металле и шлаке.
Выражение (2.91) является уравнением материального баланса, составленным при условии, что фосфор перераспределяется между металлом и шлаком и не выделяется в газовую фазу. Если при плавке величины mм и mш не изменяются, то, решив систему уравнений (2.90) и (2.91), получим
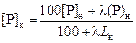 , (2.92)
, (2.92)
где l - кратность шлака, %, l = (mш /mм )100.
Степень дефосфорации
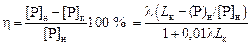 . (2.93)
. (2.93)
Если по аналогии с Lк = (P)к /[P]к ввести коэффициент Lн = (P)н /[P]н , характеризующий фактическое начальное (неравновесное) распределение фосфора, то
h = [l(Lк - Lн )]/(1 + 0,01 lLк ), (2.94)
т.е. степень дефосфорации прямо пропорциональна начальному отклонению системы металл–шлак от равновесия (Lк - Lн ). Зависимость h от Lк и l носит характер кривой с насыщением. Причем, если Lн ¹ 0, то даже при l ® ¥ величина h стремится не к 100 %, а к 100(1 - Lн/Lк) %. Это свидетельствует, в частности, о необходимости использования чистых по фосфору шлакообразующих материалов, особенно при глубокой дефосфорации.
Решение. 1. По формуле (2.87) вычислим равновесный коэффициент распределения фосфора Lк . Для этого предварительно вычислим величины K5 , Sn, xFeO , gFeO , gPO2,5 , fР , входящие в формулу (2.87).
Из уравнения (2.85) вычислим значение K5 при 1873 К:
lg K5 = 1120/T - 1,385 = -0,787; K5 = 0,163.
Выразим состав шлака в мольных (хRO) или в ионных (хR) долях. Для этого предварительно вычислим число молей оксидов nRO и число катионов nR+ в 100 г шлака. Результаты расчетов приведены ниже.
| Содержание, % | CaO 45 | SiO2 20 | FeO 16 | MnO 7 | MgO 7 | Аl2O3 5 | PO2,5 0,05 | |
| 56 | 60 | 72 | 71 | 40 | 102 | 71 | (Sn R O = 1,683) (Sn R+ = 1,732)
|
| nRO | 0,804 | 0,33 | 0,222 | 0,099 | 0,175 | 0,049 | 7×10-4 | |
| xRO | 0,476 | 0,198 | 0,132 | 0,059 | 0,104 | 0,029 | 4,2×10-4 | |
| nR+ | 0,804 | 0,33 | 0,222 | 0,099 | 0,175 | 0,098 | 7×10-4 | |
| xR+ | 0,464 | 0,192 | 0,128 | 0,057 | 0,101 | 0,057 | 4×10-4 | |
| _________ * MRO - масса моля оксида. | ||||||||
Зная ионные доли х R+ компонентов шлака, по формулам (2.88) и (2.89) определяем значения gFeO и gPO2,5 при 1873 К:
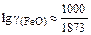 [12,18×0,057×0,192 + 5,9(0,464 + 0,101)×0,192 +
[12,18×0,057×0,192 + 5,9(0,464 + 0,101)×0,192 +
+ 10,5×0,464×4×10-4] = 0,356; g(FeO) = 2,27;
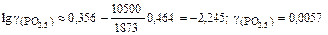 .
.
Значение fP определим по параметрам взаимодействия [3]:
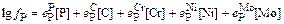 = 0,062×0,04 +
= 0,062×0,04 +
+ 0,13×0,2 - 0,03×0,4 + 0,02×2 + 0×0,2 = 0,0565; fP =1,14.
По формуле (2.87) вычислим Lк:
Lк = 31×0,163×1,14(0,132×2,27)2,5×1,68/0,0057 = 83,4 » 83.
2. По известному значению Lк определим по формуле (2.92) конечную концентрацию фосфора в металле [Р]к при l = 5 %:
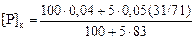 = 0,008 %,
= 0,008 %,
где (31/71) - величина в выражении (% Р) = (31/71) (% P2O5 ).
3. Степень дефосфорации
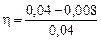 100 % = 80 %.
100 % = 80 %.
Вычисленная степень дефосфорации (80 %) соответствует равновесному распределению фосфора между металлом и шлаком. В реальных условиях степень дефосфорации несколько ниже и составляет 50–60 %.








