Решение. Подставляя в уравнение (1.29) выражения для константы равновесия K и парциального давления а также значения констант F и R, получаем
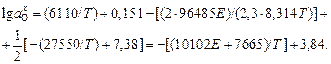
Рассчитанные значения активности кислорода приведены в таблице в исходных данных.
Примечания. 1. В качестве твердого электролита, как правило, применяют стабилизированный диоксид циркония, обладающий практически 100 %-ной ионной (по кислороду) проводимостью. При измерении активности кислорода в хорошо раскисленном металле ([% О] < 0,0010) при высоких температурах (> 1873 К) следует учитывать электронную составляющую проводимости. В этом случае [5]
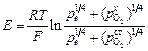 .
.
Для диоксида циркония, стабилизированного оксидом кальция,
lgpe = (-68400/T ) + 21,59.
2. Наряду со смесью Мо–МоО2 (~ 10 % МоО2) в качестве электрода сравнения часто используют смесь Cr–Cr2O3 (2–5 % Cr2О3). В этом случае
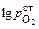 = (-39425/T ) + 8,94.
= (-39425/T ) + 8,94.
3. На основе определения активности кислорода методом э.д.с. создан прибор для экспрессного определения содержания кислорода в стали [5].
9. Расчет коэффициентов активности компонентов бинарного раствора
с помощью уравнения Гиббса – Дюгема
Задача. С помощью уравнения Гиббса – Дюгема рассчитать коэффициент активности железа в расплавах Fе–Аl при 1873 К по экспериментальным значениям коэффициента активности алюминия.
Исходные данные. Зависимость коэффициента активности алюминия (gAl) от концентрации в расплавах Fе–Аl при 1873 К [6] приведена в таблице.
Результаты расчета коэффициентов активности железа
в расплавах Fе–А1 при 1873 К с помощью уравнения Гиббса – Дюгема
| xAl | xFe | 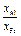
| -ln gAl | 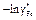
| 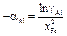
| 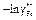
|
| 0 | 1 | 0 | 2,38 | 0 | 2,38 | 0 |
| 0,1 | 0,9 | 0,111 | 2,20 | 0,01 | 2,72 | 0,005 |
| 0,2 | 0,8 | 0,250 | 1,95 | 0,05 | 3,05 | 0,047 |
| 0,3 | 0,7 | 0,428 | 1,60 | 0,18 | 3,26 | 0,165 |
| 0,4 | 0,6 | 0,667 | 1,25 | 0,37 | 3,47 | 0,374 |
| 0,5 | 0,5 | 1,00 | 0,82 | 0,64 | 3,30 | 0,695 |
| 0,6 | 0,4 | 1,50 | 0,50 | 1,02 | 3,12 | 1,01 |
| 0,7 | 0,3 | 2,33 | 0,24 | 1,44 | 2,67 | 1,58 |
| 0,8 | 0,2 | 4,00 | 0,10 | 1,90 | 2,50 | 2,00 |
| 0,9 | 0,1 | 9,00 | 0,02 | (2,33) | 2,0 | 2,48 |
| 1,0 | 0 | ¥ | 0 | (2,80) | 0 | 2,84 |
| ________________ * Уравнение (1.31). ** Уравнение (1.32). | ||||||
Теория. Парциальные термодинамические характеристики компонентов бинарного раствора связаны уравнением Гиббса – Дюгема. Для парциальных энергий Гиббса имеем: 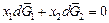 . Учитывая, что
. Учитывая, что 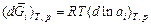 и dx1 = -dx2 , это уравнение можно записать в виде
и dx1 = -dx2 , это уравнение можно записать в виде
(1 – х2)(¶ lna1/¶ х2)T, р = -x2(¶ lna2/¶ х2)T, р.
Отсюда
(1 – х2)(¶ lng1/¶ х2)T, р = -x2(¶ lng2/¶ х2)T, р. (1.30)
Таким образом, если известен коэффициент активности одного из компонентов, например g2 , то с помощью уравнения (1.30) можно вычислить g1. Проинтегрировав уравнение (1.30), получим
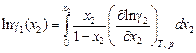
или
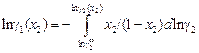 . (1.31)
. (1.31)
Решение. Определение коэффициента активности железа в расплавах Fe–Аl по заданной концентрационной зависимости коэффициента активности алюминия сводится к вычислению интеграла (1.31). Воспользуемся графическим методом интегрирования. С этой целью строим график зависимости отношения xАl/xFe от lngAl (см. рисунок). Заштрихованная на рисунке площадь равна интегралу
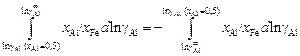
|
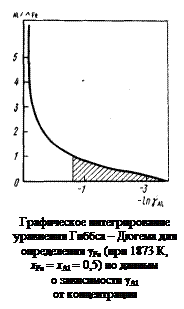 и значению lngFe при xAl = xFe = 0,5 . Рассчитанная таким образом концентрационная зависимость коэффициента активности железа приведена в таблице вмсте с исходными данными.
и значению lngFe при xAl = xFe = 0,5 . Рассчитанная таким образом концентрационная зависимость коэффициента активности железа приведена в таблице вмсте с исходными данными.
Примечания. 1. В области низких концентраций железа графическое интегрирование уравнения (1.31) затруднено по двум причинам. Во-первых, в этой области невысока точность определения величины gAl , во-вторых, отношение xAl/xFe ® ¥ при xFe ® 0, поэтому при низких значениях хFe (xFe < 0,2; хAl > 0,8) коэффициенты активности железа получены экстраполяцией зависимости lngFe к точке xFe = 0.
2. Более удобное для расчета интегральное уравнение Гиббса – Дюгема может быть получено с помощью вспомогательной функции Даркена [7]:
a2 = lng2/(1 - х2)2.
Тогда
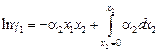 . (1.32)
. (1.32)
В данном случае подынтегральное выражение ограничено во всем концентрационном интервале 0 £ x2 £ 1. Функция aAl и результаты расчета концентрационной зависимости lngFe по уравнению (1.32) приведены в таблице.
3. Более точно интегралы в уравнениях (1.31) и (1.32) можно вычислить численными методами (трапеций, Симпсона и др.) с помощью ЭВМ.
4. Для ряда систем коэффициент активности g2 известен лишь в ограниченной области концентраций от 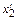 до
до 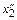 . Например, для системы Fе–С при 1873 К величина gFe известна в интервале 0,79 £ xFe £ 1. В этом случае величину gC можно рассчитать по уравнению
. Например, для системы Fе–С при 1873 К величина gFe известна в интервале 0,79 £ xFe £ 1. В этом случае величину gC можно рассчитать по уравнению
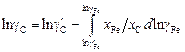 .
.
Для расчета концентрационной зависимости gC по этому уравнению необходимо знать величину 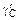 при xFe = 0,79 (
при xFe = 0,79 ( 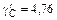 ).
).
10. Расчет стандартной энергии Гиббса
и константы равновесия химической реакции
по справочным данным
Задача. С помощью справочных таблиц определить стандартную энергию Гиббса и константу равновесия реакции восстановления хрома кремнием при 1873 К:
2(Cr2O3) + 3[Si] = 4[Cr] + 3(SiO2). (1.33)
Исходные данные. 1. Значения стандартной энергии Гиббса образования соединений (Дж/моль) заданы в виде: 1) табличных данных при 1873 К [8]: 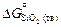 = -542070;
= -542070; 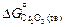 = -651079; 2) уравнений [3]:
= -651079; 2) уравнений [3]: 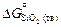 = -947000 + 198,0 Т;
= -947000 + 198,0 Т; 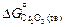 = -1131000 + 250,0 Т; 3) приведенной энергии Гиббса при 1873 К [9]:
= -1131000 + 250,0 Т; 3) приведенной энергии Гиббса при 1873 К [9]: 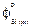 = 46,06;
= 46,06; 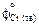 = = 51,86;
= = 51,86; 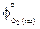 = 236,92;
= 236,92; 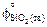 = 100,28;
= 100,28; 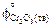 = 192,82.
= 192,82.
2. Теплота образования диоксида кремния и триоксида дихрома при 0 К [9], Дж/моль: 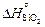 = -905717;
= -905717; 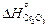 = -1134777.
= -1134777.
Теория. Стандартной энергией Гиббса химической реакции DG º называют изменение энергии Гиббса системы в результате протекания реакции при условии, что исходные вещества и продукты реакции взяты в стандартных состояниях.
Для кремния, температура плавления которого меньше заданной, за стандартное состояние примем чистый жидкий кремний. Температура плавления остальных компонентов, участвующих в реакции (1.33), превышает 1873 К, поэтому для них в качестве стандартного примем твердое состояние. При таком выборе стандартных состояний стандартная энергия Гиббса DGº равна изменению энергии Гиббса в результате реакции
2Сr2O3 (тв) + 3Si(ж) = 4Cr(тв) + 3SiO2 (тв). (1.34)
Реакцию (1.34) можно представить как сумму двух процессов:
2Сr2O3 (тв) = 4Сr(тв) + 3O2 (г) ; (1.35)
3Si(ж) + 3O2 (г) = 3SiO2 (тв) . (1.36)
Так что 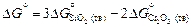 , где
, где 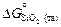 и
и 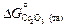 - стандартные энергии образования оксидов при 1873 К. Константа равновесия K определяется известным соотношением: DG o = -RТ lnК. Для определения энергии образования химических соединений из элементов по уравнениям (1.35) и (1.36) используют справочные таблицы (таблицы стандартных величин), которые составлены по-разному: 1) значения DGº (Т) приведены с определенным шагом по температуре (обычно 100 К); 2) приведены значения коэффициентов А и В, характеризующих температурную зависимость энергии Гиббса: DGº(Т) = А + ВТ, указаны температурные интервалы, в которых коэффициенты А и В принимают постоянными величинами, независимыми от температуры; 3) даны приведенные энергии Гиббса веществ fº(Т):
- стандартные энергии образования оксидов при 1873 К. Константа равновесия K определяется известным соотношением: DG o = -RТ lnК. Для определения энергии образования химических соединений из элементов по уравнениям (1.35) и (1.36) используют справочные таблицы (таблицы стандартных величин), которые составлены по-разному: 1) значения DGº (Т) приведены с определенным шагом по температуре (обычно 100 К); 2) приведены значения коэффициентов А и В, характеризующих температурную зависимость энергии Гиббса: DGº(Т) = А + ВТ, указаны температурные интервалы, в которых коэффициенты А и В принимают постоянными величинами, независимыми от температуры; 3) даны приведенные энергии Гиббса веществ fº(Т):
f°(Т) = -[G°(Т) - 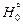 ]/T, (1.37)
]/T, (1.37)
где 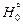 - энтальпия вещества при 0 К.
- энтальпия вещества при 0 К.
Расчет констант равновесия с использованием приведенных энергий Гиббса (случай 3) проводится по уравнению
RlnK = Df°(Т) – 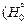 /T),
/T),
где Df°(Т) - изменение приведенной энергии Гиббса в результате протекания реакции.
Решение. По исходным данным определяем стандартные энергии образования твердого диоксида кремния и кристаллического триоксида дихрома.
1. Из таблиц [8] имеем: 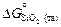 = -542070 Дж/моль;
= -542070 Дж/моль; 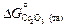 = = -651079 Дж/моль.
= = -651079 Дж/моль.
2. В соответствии с приведенными уравнениями
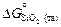 = – 947000 + 198,0Т = -947000 + 198,0×1873 =
= – 947000 + 198,0Т = -947000 + 198,0×1873 =
= -576146 Дж/моль;
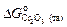 = -1131000 + 250,0Т = -1131000 + 250,0×1873 = = -662750 Дж/моль.
= -1131000 + 250,0Т = -1131000 + 250,0×1873 = = -662750 Дж/моль.








