Термины, условные обозначения и единицы измерения
ni – число молей (атомов, ионов) i-го вещества
xi – мольная (атомная, ионная) доля
ci или % i – массовая доля
i (j, k) – индекс, обозначающий компонент раствора или смеси (для растворителя i = 1)
Mi – относительная молекулярная (атомная) масса
p – давление, Па (атм)*
pi – парциальное давление, Па (атм)*
V – объем, м3
T – температура, К
G – энергия Гиббса, Дж
H – энтальпия, Дж
S – энтропия, Дж × К–1
C – теплоемкость, Дж × К–1 × моль–1
f – приведенная энергия Гиббса, Дж × К–1
mi – химический потенциал, Дж
D – изменение (например, DН – изменение энтальпии)
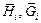 – парциальные энтальпия, энергия Гиббса, Дж
– парциальные энтальпия, энергия Гиббса, Дж
DHi – относительная парциальная энтальпия (на моль i), Дж
DHm – относительная интегральная энтальпия (на моль раствора), Дж
K – константа равновесия реакции
k – константа скорости реакции
Li, Ki – коэффициент распределения i-гo компонента
ai, gi – активность и коэффициент активности (стандартное состояние – чистый компонент)
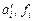 – активность и коэффициент активности (стандартное состояние – 1 %-ный идеальный разбавленный раствор)
– активность и коэффициент активности (стандартное состояние – 1 %-ный идеальный разбавленный раствор)
º – индекс, показывающий, что данная характеристика относится к стандартному состоянию (например, 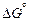 – стандартная энергия Гиббса процесса)
– стандартная энергия Гиббса процесса)
¥ – индекс, показывающий, что данная характеристика относится к идеальному разбавленному раствору (например, 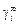 – коэффициент активности для концентраций, при которых соблюдается закон Генри)
– коэффициент активности для концентраций, при которых соблюдается закон Генри)
изб – индекс, показывающий, что данная характеристика является избыточной величиной (например, 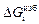 – избыточная энергия Гиббса)
– избыточная энергия Гиббса)
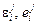 – параметры взаимодействия 1-го порядка
– параметры взаимодействия 1-го порядка
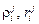 – параметры взаимодействия 2-го порядка
– параметры взаимодействия 2-го порядка
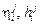 – энтальпийные параметры 1-го порядка
– энтальпийные параметры 1-го порядка
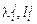 – энтальпийные параметры 2-го порядка
– энтальпийные параметры 2-го порядка
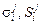 – энтропийные параметры 1-го порядка
– энтропийные параметры 1-го порядка
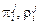 – энтропийные параметры 2-го порядка
– энтропийные параметры 2-го порядка
s – поверхностное натяжение, мДж × м–2
υ – скорость, м × с–1
D – коэффициент диффузии, м2 × с–1
b – коэффициент массопереноса, м × с–1
z – координационное число, число мест, которое адсорбент предоставляет адсорбату
r – плотность, кг × м–3
t – время, с; параметр теории квазирегулярных растворов, К
R – универсальная газовая постоянная, 8,31 Дж × моль–1×К–1
r – радиус, м
F – площадь, м2; сила, Н
k – постоянная Больцмана, 1,38 × 10–23 Дж × К–1
Г – адсорбция, моль × м–2
wА – работа адгезии, мДж × м–2
wК – работа когезии, мДж × м–2
w – индекс, показывающий, что данная характеристика относится к поверхностному слою
q – краевой угол смачивания, град
h – динамическая вязкость, Па × с
n – кинематическая вязкость, м2 × с–1; валентность
П, W – поток массы, кг × м–2 × с–1
E(n, b, D) – энергия активации вязкого течения (g), массопереноса (b) и диффузии (D), Дж × моль–1
1. Термодинамика металлических расплавов
1. Парциальные и интегральные термодинамические величины
Задача. Определить парциальную и относительную парциальную энтальпии кремния в жидком железе, а также относительную интегральную энтальпию расплавов Fe–Si по результатам калориметрических измерений.
Исходные данные. 1. Теплоты смешения Q образцов кремния заданной массы т с 300 г жидкого железа (таблица). 2. Температура образцов кремния 298 К, температура расплава 1873 К. 3. Энтальпия кремния при 1873 К: 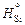 = 91,1 кДж/моль.
= 91,1 кДж/моль.








