Рисунок 1.4 – Фото Жозефа Лаланда
Робота над удосконаленням цього акумулятора була виконана багатьма вченими, такими, як Реньє, Сомеліном, Даріусом та ін. У 1901 році новий тип несвинцевого акумулятора був запатентований одночасно Едісоном і Юнгнером.
Цей акумулятор складається з двох пластин, що містять: одна – окис заліза, інша – чорний окис нікелю, опущених у 20 % розчин їдкого лугу з додаванням 0,5–1 % їдкого літію.
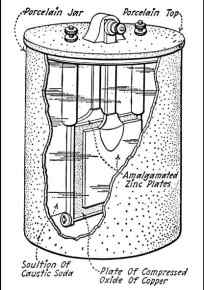
Рисунок 1.5 – Акумулятор Едісона – Лаланда
Елементи Едісона і Юнгнера набули широкого застосування в тих випадках, коли необхідні мала вага і невибагливість акумуляторів до зарядки, оскільки вони можуть перебувати як завгодно довго в розрядженому стані. Витіснити свинцеві акумулятори вони не змогли, завдяки їх високій ціні, малій віддачі ємності та низькій напрузі, що виробляється ними. Таким чином, залізонікелевим акумуляторам відведене значне місце у всіх переносних і рухомих установках, у той час як свинцеві акумулятори почали широко використовуватися у стаціонарних установках.

Рисунок 1.6 – Фото Томаса Едісона біля електромобіля (1912 рік)
1.2 Перші акумулятори
У техніці акумуляторами називають пристрої, які накопичують енергію для її подальшого використання. При цьому акумулятор може бути не тільки електричним. Найбільш простим видом акумулятора можна вважати стислу або розтягнуту пружину, в якій накопичується механічна енергія, або важкий маховик, розкручений до великої кількості обертів і такий, що запасає кінетичну енергію. На гідроакумулюючих станціях надлишок електроенергії використовується для підняття води з нижнього резервуара у верхній. Існують пневматичні, теплові та електричні акумулятори.
Давайте ще раз повернемося до того часу, коли Олександро Вольта створив свою першу батарею. Для більшості це було чудо, яке ще більше привернуло увагу багатьох фізиків до електричних дослідів. Рік чи два тому вчитель музики в Парижі Готеро, який проводив експеримент із розкладання води на кисень і водень за допомогою вольтова стовпа, визначив, що дві золоті пластини нескладного приладу, з'єднані разом, по закінченні експерименту дають таке саме відчуття, як і батарея Вольти, тільки значно слабкіше. Витлумачити це незначне явище ніхто не міг, та воно було й не надто вражаючим. Але кілька років тому до цього досліду повернувся німецький фармацевт Іоганн Вільгельм Ріттер, що став пізніше за сміливість думки і широту поглядів членом Мюнхенської академії. Він спорудив стовпчик із сорока лише мідних штирів, прокладених сукниною, які були змочені підкисленою водою. З'єднав полюси стовпчиків із вольтовою батареєю і через деякий час переконався, що його конструкція зарядилася електрикою. Тепер вторинні штирі, що заряджаються, привернули до себе увагу багатьох. Тим більше, що існуючі гальванічні елементи дуже швидко втрачали свою силу через поляризацію.
У 1839 році Грове винайшов газовий вторинний елемент, який давав струм тільки після зарядження його від якогось стороннього джерела.
Газовий елемент Грове складається з платинових електродів; під час зарядження над одним накопичується водень, над іншим – кисень. Електролітом служить сірчана кислота. При розряді проходить зворотна реакція окиснення водню і відновлення кисню. Напруга становить близько 1В. Цей елемент є прототипом паливних елементів. Але через незручності користування газовий елемент Грове поширення не дістав. (Існує й інший елемент з ім'ям Грове, і бажано їх не плутати).
Приблизно у 1859–1860 роках у лабораторії Олександра Беккереля – іншого представника славної династії французьких фізиків – працював асистентом Гастон Планте. Молодий чоловік вирішив зайнятися поліпшенням вторинних елементів, щоб зробити їх надійними джерелами струму для телеграфії. Спочатку він замінив платинові електроди "газового елемента" Грове свинцевими.

Рисунок 1.7 – Газовий елемент Грове
А після численних експериментів і пошуків взагалі перейшов до двох тонких свинцевих пластин. Він їх переклав сукниною і накрутив цей сендвіч на дерев'яну паличку, щоб він поміщався у круглу скляну банку з електролітом. Далі підключив обидві пластини до батареї. Через деякий час вторинний елемент зарядився і сам виявився здатний давати досить відчутний постійний струм. При цьому, якщо його відразу не розряджали, здатність зберігати електрорушійну силу залишалася на досить тривалий час. Це було справжнє народження накопичувача електричної енергії, або акумулятора.
Перші електричні акумулятори Гастона Планте мали невелику ємність, тобто накопичували зовсім мало електрики. Але, з'єднавши декілька банок послідовно, напругу батареї можна було підвищити, а при паралельному їх увімкненні підвищувалася ємність. При цьому струм приладу ставав тим більшим, чим більша площа поверхні пластин стикалася з розчином електроліту.

Рисунок 1.8 – Один з перших акумуляторів
Потім було виявлено таке: якщо заряджений спочатку прилад розрядити, потім пропустити через нього струм у зворотному напрямку та ще й виконати цю операцію не один раз, то збільшується шар оксиду на електродах, і ємність вторинного елемента зростає. Цей процес отримав назву формування пластин і займав у винахідника Камілла Фора близько трьох місяців.
Камілл Фор з юних років захоплювався технікою, але він був бідний і не здобув освіти. Вимушений заробляти на життя, Камілл змінив безліч спеціальностей. Був робітником, креслярем, техніком, хіміком на англійському пороховому заводі, працював і у Планте. Різнобічні практичні знання стали в пригоді самоучці.
Після Паризької виставки 1878 року Фору прийшла ідея нового методу формування пластин. Він спробував заздалегідь покривати їх оксидом свинцю, свинцевим суриком. При заряджанні сурик на одній із пластин перетворювався у перекис, а на іншій – відповідно в оксид. При цьому шар оксиду набирав дуже пористої будови, а отже, площа його поверхні істотно збільшувалася. Процес формування проходив значно швидше. Акумулятори Фора при тій самій вазі запасали значно більше електричної енергії, ніж акумулятори Планте. Іншими словами, їх енергоємність була вищою. Ця обставина привернула до них велику увагу електротехніків.
У кінці століття в багатьох країнах, на вулицях і в будинках з'явилося електричне освітлення. Лампи розжарювання живилися на той час енергією ще малопотужних машин постійного струму. Рано вранці та пізно ввечері, коли енергії було потрібно більше, на допомогу машинам приходили акумулятори. Це було істотно дешевше, ніж ставити додаткові генератори. Тим більше що в денні та нічні години акумулятори могли заряджатися, накопичуючи надлишки вироблюваної машинами енергії.
Подальше вдосконалення свинцево-кислотних акумуляторів відбувалося шляхом поліпшення їх конструкції та зміни технології виробництва пластин. Незважаючи на велике поширення, свинцевий акумулятор – досить примхливе дітище електротехніки.
Недоліки кислотних акумуляторів ще на зорі їх розвитку спонукали винахідників шукати заміну свинцю. Спроб було чимало. Більшість безуспішних. Удача випала на долю Томаса Алви Едісона. Після безлічі експериментів американський винахідник створив залізо-нікелевий лужний акумулятор, який широко використовується і в наші дні. У ньому вміщений негативний електрод, виконаний із пористого заліза або кадмію з великою робочою поверхнею. Позитивний електрод – нікелевий, оточений окисом тривалентного нікелю. Як електроліт застосовується 20 % розчин їдкого калію або їдкого натрію. Корпус найчастіше виготовляється зі сталі, щоправда, електрорушійна сила лужного акумулятора трохи нижча, ніж свинцевого. Коефіцієнт корисної дії також менший (приблизно у два рази). Та й коштує лужний акумулятор дорожче. Але він добре витримує перевантаження, не чутливий до надлишкового заряду і глибокого розряду, міцний, легко переносить перегрів і не потребує ремонту.
І зараз у всіх промислово розвинених країнах увагу багатьох науково-дослідних колективів спрямовано на створення нових типів акумуляторів і суперакумуляторів з метою підвищення кількості запасу енергії на одиницю ваги акумулятора.
Професор Петров В. В. ще у 1802 році, вивчаючи явище поляризації, на більше ніж п'ятдесят років раніше від Планте сконструював газовий акумулятор.
Російські вчені Ленц Е. Х. (1804–1865 рр.) і Якобі Б. С. (1801–1874 рр.) теоретично обґрунтували явище поляризації.
Неодноразово повторюючи досліди з поляризацією свинцевих пластин, Планте виявив на одній пластині утворення перекису свинцю, а на іншій – губчастого свинцю і на основі цього явища сконструював у 1860 р. перший, практично діючий кислотний акумулятор.
Для скорочення часу формування пластин професор Петербурзького університету Лачинов Д. А. (1842–1902 рр.) запропонував застосовувати окиси свинцю, що наносяться на свинцеві пластини, а офіцер російського флоту Тверитинов В. А. за основу використовував для пластин свинцеву решітку, в яку вмазувалася паста із свинцевих окисів, запропонованих Лачиновим Д. А.
Розроблена ними конструкція так званих решітчастих пластин забезпечує велику ємність на одиницю ваги і застосовується в сучасних кислотних акумуляторах.
Розділ 2
БУДОВА АКУМУЛЯТОРІВ
2.1 Призначення акумуляторів
Акумулятором називається електричний пристрій, який при заряді від джерел постійного струму накопичує електричну енергію, а при розряді віддає її споживачам, будучи у цьому разі джерелом постійного струму.
Акумулятор – це хімічне джерело струму, що складається з позитивного та негативного електродів і електроліту, дія якого ґрунтується на використанні оборотних електрохімічних систем.
Простий свинцевий акумулятор (рис. 2.1) складається з позитивного електрода, активною речовиною якого є двоокис свинцю PbO2 (темно-коричневого кольору), і негативного електрода, активною речовиною якого є губчастий свинець РЬ (сірого кольору). Якщо обидва електроди помістити в посудину з електролітом (розчином сірчаної кислоти H2SО4 в дистильованій воді), то між електродами виникне різниця потенціалів. При ввімкненні до електродів електричного опору (споживача) в ланцюзі проходитиме електричний струм, і акумулятор буде розряджатися. При розряді акумулятора губчастий свинець і двоокис свинцю негативного і позитивного електродів перетворяться в сірчанокислий свинець (сульфат свинцю) PbSO4.
Під час розряду витрачається сірчана кислота з електроліту, і одночасно в електроліт виділяється вода. Тому у міру розряду свинцевого акумулятора зменшується концентрація сірчаної кислоти, через що щільність електроліту знижується. При заряді відбуваються зворотні хімічні реакції, в результаті яких із сульфату свинцю на позитивному електроді знову утворюється двоокис свинцю, а на негативному електроді – губчастий свинець. Під час заряду в електроліт виділяється сірчана кислота, і витрачається вода. При цьому щільність електроліту у міру заряду зростає.
Таким чином, свинцевий акумулятор має властивість оборотності, тобто здатність накопичувати електричну енергію від стороннього джерела струму в процесі заряду, зберігати її деякий час і віддавати в процесі розряду.
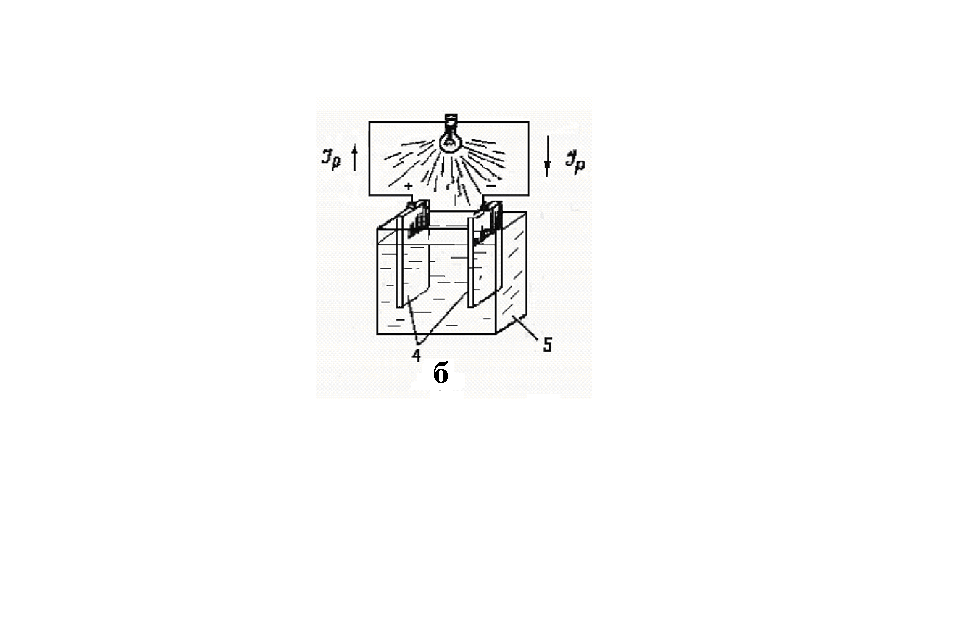
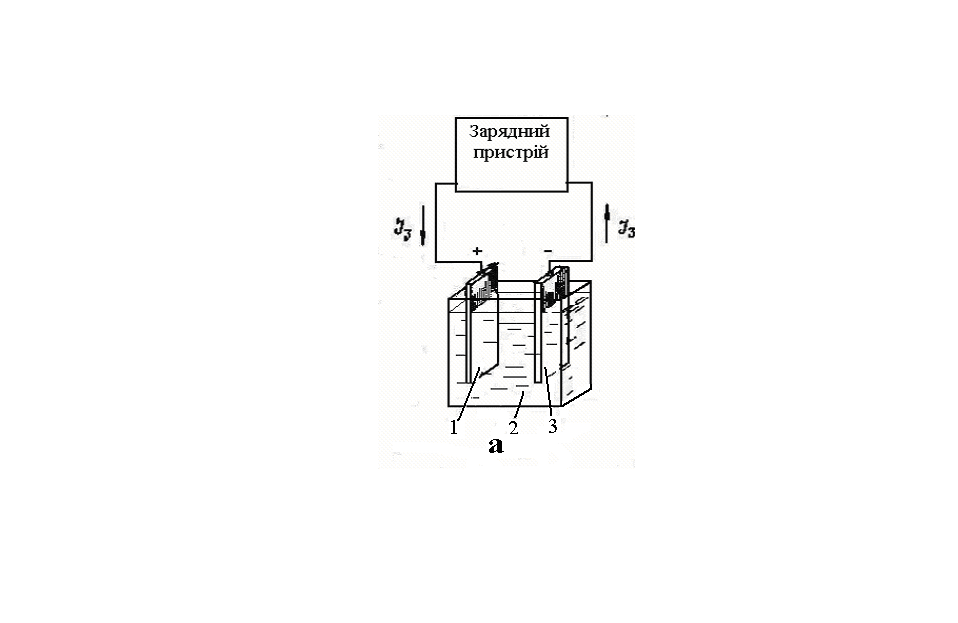
Мал. 2.1 – Робота простого акумулятора:
а – при заряді; б – при розряді;
1 – двоокис свинцю; 2 – електроліт підвищеної щільності;
3 – губчастий свинець; 4 – сульфат свинцю; 5 – електроліт низької
щільності
Автомобільний акумулятор виконує три функції: по-перше він живить електричним струмом стартер при запуску двигуна, по-друге, живить деякі електричні пристрої, наприклад сигналізацію зовнішніх та внутрішніх світлових приладів, коли двигун не працює. Нарешті, він «допомагає» генератору, коли той не справляється з навантаженням.
2.2 Типи акумуляторів
Розрізняють лужні та кислотні (свинцеві) акумулятори.
Лужний кадмієво-нікелевий акумулятор (залізо і гідрат окису нікелю в розчині їдкого лугу).
Кислотний свинцевий акумулятор (свинець та двоокис свинцю в розчині сірчаної кислоти).
2.2.1 Лужні акумулятори
Переваги: мають великий строк служби, високу механічну міцність та простоту в експлуатації.
Недоліки: мають порівняно великий внутрішній опір і це обмежує потужність, яка може бути їм віддана при розряді великим струмом.
За складом електродів (активної маси) лужні акумулятори поділяють на:
– кадмієво-нікелеві;
– залізонікелеві;
– цинк-нікелеві;
– сріблоцинкові;
а за способом утримання електродів – на:
– ламельні;
– безламельні.
Безламельні акумулятори мають більшу ємність і менші розміри. Останнім часом почали застосовувати стартерні залізонікелеві акумулятори, що працюють при низьких температурах краще, ніж кислотні. Для одержання великих імпульсних струмів при низьких і високих температурах та значних змінах атмосферного тиску застосовують срібло-цинкові акумулятори.
2.2.2 Свинцево-кислотні акумулятори
На базових гусеничних машинах і автомобілях в основному встановлюють сірчанокислотні свинцеві акумуляторні батареї, призначені:
– для запуску двигунів машин за допомогою стартера;
– для живлення електричною енергією ввімкнених споживачів, коли двигун не працює або працює на малих обертах;
– для живлення електричною енергією споживачів, коли потужність увімкнених споживачів перевищує потужність, що віддається генератором.
Цей тип акумуляторів має високу електрорушійну силу (ЕРС), малий внутрішній опір і найголовніше: вони допускають великий розрядний струм, що дуже важливо для живлення стартерних виробів цих машин.
Простіший кислотний свинцевий акумулятор складається із скляної або пластмасової банки, в яку опущені дві свинцеві пластини і залитий електроліт – розчин із хімічно чистої сірчаної кислоти і дистильованої води.
Для того щоб акумулятор міг давати струм, його необхідно завчасно зарядити, тобто пропустити через нього постійний струм від джерела.
Один акумулятор (акумуляторний елемент) розвиває ЕРС близько 2 В, ємність його залежить від розмірів і кількості пластин.








