Спектры испускания атома водорода
Умеренкова Е. 451 гр.
Конспект лекции "Опыты Резерфорда по рассеянию альфа -частиц. Ядерная модель атома Резерфорда. Постулаты Бора. Спектры испускания атома водорода"
 Модели Томсона и Резерфорда
Модели Томсона и Резерфорда
 | |||
 | |||
 Постулаты Бора
Постулаты Бора
Спектры испускания атома водорода
Спектры атомов подразделяют на спектры испускания и спектры поглощения. Для получения спектра испускания водорода его необходимо разогреть до высокой температуры и излучение пропустить через оптическую систему, состоящую из коллиматора и призмы. При этом на экране, размещенном за призмой, можно наблюдать тонкие цветные линии, образующие спектральную серию, называемую серией Бальмера. Частоты 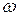 спектральных линий серии Бальмера определяются из формулы:
спектральных линий серии Бальмера определяются из формулы:
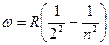 ,
, 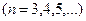 ,
,
где 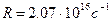 - постоянная Ридберга. Кроме одной спектральной серии, расположенной в видимой части спектра, у водорода имеется одна спектральная серия в ультрафиолете, называемая серией Лаймана:
- постоянная Ридберга. Кроме одной спектральной серии, расположенной в видимой части спектра, у водорода имеется одна спектральная серия в ультрафиолете, называемая серией Лаймана:
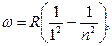
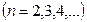 ,
,
а также спектральные серии в инфракрасной части спектра:
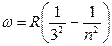 ,
, 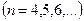 , (серия Пашена),
, (серия Пашена),
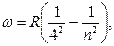
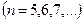 , (серия Брэкета),
, (серия Брэкета),
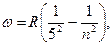
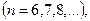 (серия Пфунда).
(серия Пфунда).
В низкочастотной области спектр атома водорода простирается вплоть до радиодиапазона. В настоящее время в спектре межзвездного водорода обнаружены спектральные линии, соответствующие длинам волн 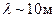 . Если обратить внимание на структуру соотношений (6.1)-(6.5), то видно, что все они могут быть представлены в общем виде:
. Если обратить внимание на структуру соотношений (6.1)-(6.5), то видно, что все они могут быть представлены в общем виде:
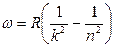 ,
,
где 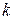 и
и 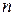 целые числа, причем
целые числа, причем 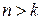 . Соотношение называют обобщенной формулой Бальмера.
. Соотношение называют обобщенной формулой Бальмера.
Спектр поглощения водорода можно получить при пропускании через него электромагнитного излучения с непрерывным спектром. Тогда после прохождения через коллиматор и призму излучение на экране разворачивается в спектр, представляющий собой радугу на фоне которой заметны тонкие черные полоски. Черным полоскам соответствуют частоты, определяемые формулой. Таким образом, спектр излучения и спектр поглощения водорода взаимно дополняют друг друга до радуги.
Атом каждого химического элемента обладает своим уникальным спектром. Поэтому на анализе спектрального состава излучения основан важнейший метод химического анализа. Наличие в смеси того или иного химического элемента может быть установлено по присутствию в спектре излучения его характерных спектральных линий. Оказывается, что из анализа спектральных линий может быть получена и другая важная информация. Так по ширине и интенсивности спектральных линий можно судить о температуре и концентрации вещества в смеси. Спектральный анализ особенно широко применяется в астрофизике поскольку вещество удаленных космических объектов недоступно для других методов химического анализа. В настоящее время исследование спектров излучения позволило установить химический состав звезд, межзвездной среды и целого ряда других космических объектов.








