Общее число нуклонов в ядре называется массовым числом и обозначается буквой А.
Так, например, для азота 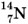 массовое число А = 14, для железа
массовое число А = 14, для железа 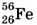 А = 56, для урана
А = 56, для урана 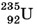 А = 235.
А = 235.
Понятно, что массовое число А численно равно массе ядра m (взятой из таблицы Менделеева), выраженной в атомных единицах массы и округлённой до целых чисел (поскольку масса каждого нуклона примерно равна 1 а. е. м.). Например, для азота m ≈ 14 а. е. м., для железа m ≈ 56 а. е. м. и т. д.
Число протонов в ядре называется зарядовым числом и обозначается буквой Z. Оно совпадает с порядковым номером элемента в таблице Менделеева.
Например, для азота 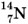 зарядовое число Z = 7, для железа
зарядовое число Z = 7, для железа 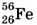 Z = 26, для урана
Z = 26, для урана 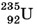 Z = 92 и т. д.
Z = 92 и т. д.
Заряд каждого протона равен элементарному электрическому заряду. Поэтому зарядовое число Z численно равно заряду ядра, выраженному в элементарных электрических зарядах. Для каждого химического элемента зарядовое число равно атомному (порядковому) номеру в таблице Д. И. Менделеева.
Ядро любого химического элемента в общем виде обозначается так: 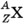 (под X подразумевается символ химического элемента).
(под X подразумевается символ химического элемента).
Число нейтронов в ядре обычно обозначают буквой N. Поскольку массовое число А представляет собой общее число протонов и нейтронов в ядре, то можно записать: А = Z + N.
На основе протонно-нейтронной модели строения атомных ядер было дано объяснение некоторым экспериментальным фактам, открытым в первые два десятилетия XX в.
Так, в ходе изучения свойств радиоактивных элементов было обнаружено, что у одного и того же химического элемента встречаются атомы с различными по массе ядрами.
Одинаковый заряд ядер свидетельствует о том, что они имеют один и тот же порядковый номер в таблице Д. И. Менделеева, т. е. занимают в таблице одну и ту же клетку, одно и то же место. Отсюда и произошло название всех разновидностей одного химического элемента: изотопы (от греч. слов isos — одинаковый и topos — место).
· Изотопы — это разновидности данного химического элемента, различающиеся по массе атомных ядер.
Благодаря созданию протонно-нейтронной модели ядра (т. е. примерно через два десятилетия после открытия изотопов), удалось объяснить, почему атомные ядра с одним и тем же зарядом обладают разными массами. Очевидно, ядра изотопов содержат одинаковое число протонов, но различное число нейтронов.
Так, например, существует три изотопа водорода: 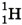 (протий),
(протий), 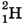 (дейтерий) и
(дейтерий) и 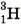 (тритий). Ядро изотопа
(тритий). Ядро изотопа 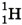 вообще не имеет нейтронов — оно представляет собой один протон. В состав ядра дейтерия
вообще не имеет нейтронов — оно представляет собой один протон. В состав ядра дейтерия 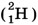 входят две частицы: протон и нейтрон. Ядро трития
входят две частицы: протон и нейтрон. Ядро трития 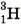 состоит из трёх частиц: одного протона и двух нейтронов.
состоит из трёх частиц: одного протона и двух нейтронов.
Гипотеза о том, что атомные ядра состоят из протонов и нейтронов, подтверждалась многими экспериментальными фактами.
3. Запиши решенную задачу

|

Домашнее задание
- выучить конспект
- изучить §47 и §49 учебника
- решить задачу
Задача1. Определите число протонов, нейтронов и электронов
а) в атоме алюминия 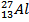
б) в атоме изотопа радия 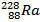
- просмотри видео (для желающих)
https://www.youtube.com/watch?time_continue=25&v=0T7DNFbB6tY&feature=emb_logo
https://vk.com/video270324250_171004613
Выполненное домашнее задание выслать сегодня 9 апреля до 19.00.








