Тема урока: Опыты Резерфорда. Ядерная модель атома. Модель ядра. Зарядовое и массовое числа.
Дата 9 апреля 2020 год
Предмет Физика
Класс 9
Тема урока: Опыты Резерфорда. Ядерная модель атома. Модель ядра. Зарядовое и массовое числа.
Задание на урок
1. Запиши число, классная работа в рабочей тетради.
2. Прочитай предложенный материал, выписывая то, что выделено красным.
В истории развития физики одна из самых интересных и увлекательных страниц – это история открытия сложного строения атома. На протяжении веков люди думали о строении вещества. О том, что вещество состоит из частиц, знали давно. Около 420 г. до н.э. греческий учёный, философ Демокрит поддержал гипотезу о том, что материя состоит из крошечных неделимых частиц. По-гречески atomos означает «неделимый», поэтому эти частицы назвали атомами. Долгое время считали атом неделимой частицей.
Демокрит (460-370 гг. до н.э.). Демокрит происходил из богатого и знаменитого рода в Северной Греции. Все доставшиеся ему в наследство деньги он потратил на путешествия. За это его осудили: по греческим законам растрата отцовского имущества являлась серьезным преступлением. Но он был оправдан, так как ему удалось доказать, что в своих путешествиях он приобрел обширные знания.
Основные элементы его картины природы таковы:
· все тела состоят из атомов;
· атомы имеют форму правильных многогранников: куба («атомы земли»), тетраэдра («атомы огня»), октаэдра («атомы воздуха»), икосаэдра («атомы воды»).
Прошло более 20 столетий, прежде чем были получены экспериментальные подтверждения идеи атомистического строения вещества.
В России идеи о мельчайших частицах вещества развивал Михаил Васильевич Ломоносов (1711-1765). Различая два вида частиц материи, он дает им названия “элементы” (равные понятию “атом”) и “корпускулы” (равные понятию “молекула”). По Ломоносову, “элемент есть часть тела, не состоящая из каких-либо других меньших частиц”, а “корпускула есть собрание элементов в одну небольшую массу”.
Английский ученый Джон Дальтон (1766-1844) впервые предпринял попытку количественного описания свойств атомов. Он проводил опыты с газами и изучал пути их соединения. Учёный обнаружил, что кислород и водород, образуя воду, всегда соединяются в одних и тех же пропорциях по массе, исходя из этого, он сделал вывод, что вещества состоят из атомов, атом неделимая частица – твёрдый шарик, который переходит от одной молекулы к другой в ходе химических реакций.
Именно им было введено понятие атомной массы и составлена первая таблица относительных атомных масс различных химических элементов. При этом атом представляется как мельчайшая неделимая, то есть бесструктурная, частица вещества. То, что вещество состоит из атомов, было доказано.
Выстраивалась следующая логическая цепочка:
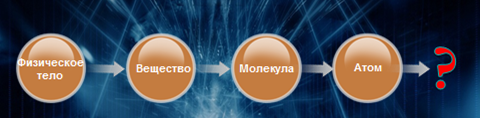
Оставалось ответить только на один вопрос: как устроен атом?
В конце XIX в. появились факты, свидетельствующие, что атом имеет сложное строение.
Модель Томсона.
Следующий шаг в данном направлении сделал английский физик Джозеф Джон Томсон. В 1897 году он доказал, что катодные лучи – не что иное, как потоки отрицательно заряженных частиц. Так был открыт электрон. 30 апреля 1897 г., когда Джозеф Джон Томсон доложил о своих исследованиях, считается “днём рождения” электрона.
Первая достаточно разработанная модель атома была предложена Томсоном. Согласно этой модели вещество в атоме несет положительный заряд и равномерно заполняет весь объем атома. Электроны “вкраплены” в атом, словно изюм в булку. Суммарный заряд электронов равен положительному заряду атома. Поэтому атом в целом электрически нейтрален. Модель так и назвали “ПУДИНГ С ИЗЮМОМ”.

Первая модель атома сыграла положительную роль: в дальнейшем была использована верная идея о слоях электронов в атоме, о потере электронов атомами. Однако скоро обнаружилось несоответствие модели реальной действительности.
Опыт Резерфорда.
Ошибочность модели Томсона вскоре доказал английский физик Эрнест Резерфорд. Основные работы Резерфорда относятся к физике атома и ядра. В 1908-1911 годах под его руководством были выполнены опыты по рассеянию альфа-частиц (ядер гелия, имеющих положительный заряд) металлической фольгой. Идея опыта была проста. Если модель атома Томсона соответствует действительности, то, пропуская через очень тонкую металлическую фольгу узкий пучок быстрых альфа-частиц, экспериментаторы не должны обнаружить сколь-либо заметного отклонения этих частиц.

Альфа-частицы от радиоактивного источника, пройдя через диафрагму, попадают на тонкую металлическую фольгу из золота. Она имеет толщину около микрона, т.е. состоит приблизительно из 3000 атомных слоев. При попадании альфа-частицы на экран возникает свечение люминесцентного слоя.
Наблюдения из опыта показали, что альфа-частицы разделились на три группы:
· большинство альфа-частиц легко проходит через фольгу, не отклоняясь;
· некоторое количество альфа-частиц отклоняется на небольшие углы;
· есть альфа-частицы, отклоняющиеся от фольги на углы более 90 градусов, т.е. частицы были отброшены назад.
Объясним результаты опыта.
- Большинство альфа-частиц легко проходит через фольгу не отклоняясь, значит, на своём пути они не встречали препятствий.
- Тот факт, что многие альфа-частицы пролетают через тысячи атомов золота, не взаимодействуя с ними, говорит о том, что атом не является сплошным, в нём есть пустоты. (Модель атома Томсона не подтверждается).
- Некоторое количество альфа-частиц отклоняется на небольшие углы, так как положительные частицы притягиваются к отрицательным, следовательно, в фольге есть отрицательные частицы.
- Альфа-частицы, отклоняющиеся от фольги на углы более 90 градусов, столкнулись с положительной частицей, а одноимённые заряды отталкиваются, и начинают двигаться в противоположную сторону.
Последнего результата никто не ожидал, так как все в то время придерживались модели Томсона, согласно которой атомы представлялись настолько “рыхлыми”, что не были способны вызвать столь значительные отклонения частиц
.
Проанализировав результаты опытов, Резерфорд пришёл к выводу:
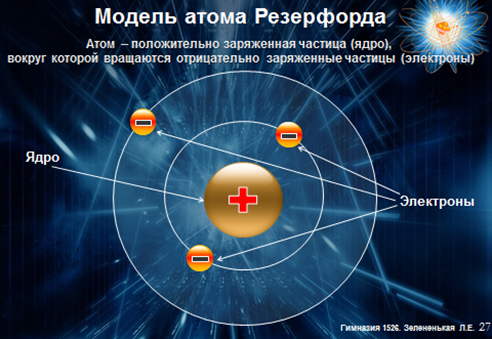
· В центре атома находится массивное положительно заряженное ядро, занимающее малый объем атома;
· вокруг ядра движутся электроны, масса которых значительно меньше массы ядра;
· атом электрически нейтрален
Модель атома Резерфорда называют планетарной за сходство со строением Солнечной системы
Такова электронно-ядерная модель атома по Резерфорду
На основании результатов выше описанных опытов Резерфорд сумел оценить размеры атомных ядер. Оказалось, что радиус ядра имеет порядок 10–12 см (10 -14 м), т.е. оно в десятки и даже в сотни тысяч раз меньше атома.
Таким образом, в результате опытов по рассеянию альфа-частиц, проведенных Резерфордом, была доказана несостоятельность модели атома Томсона, выдвинута ядерная модель строения атома и определен порядок диаметров атомных ядер.
Строение ядра.
Ядро имеет сложную структуру. Открытие нейтрона дало толчок к пониманию того, как устроены ядра атомов.
В том же 1932 г., когда был открыт нейтрон, советский физик Дмитрий Дмитриевич Иваненко и немецкий физик Вернер Гейзенберг предложили протонно-нейтронную модель строения ядер, справедливость которой была впоследствии подтверждена экспериментально.
В состав атомного ядра входят частицы: протоны и нейтроны. Протоны и нейтроны называются нуклонами (от лат. nucleus — ядро). Используя этот термин, можно сказать, что атомные ядра состоят из нуклонов.








