Окисление аминокислот
Оглавление
Введение. 2
Окисление аминокислот. 3
Отщепление аминогрупп. 3
Расщепление углеродных скелетов. 4
Введение
Большую часть метаболической энергии, вырабатываемой в тканях, поставляют процессы окисления углеводов и триацилглицеролов. У взрослого мужчины до 90% всей потребности в энергии покрывается из этих двух источников. Остальную энергию (в зависимости от рациона от 10 до 15%) дает окисление аминокислот.
Хотя роль аминокислот в организме определяется в первую очередь тем, что они служат строительными блоками для биосинтеза белков, в известных условиях они могут претерпевать и окислительное расщепление. Это возможно в трех случаях:
1. Если аминокислоты, высвобождающиеся при обычном динамическом обновлении белков, не используются для синтеза новых белков, то они подвергаются окислительному расщеплению.
2. Если организм получает с пищей больше аминокислот, чем это ему необходимо для белкового синтеза, то избыточное их количество расщепляется, потому что аминокислоты не откладываются в организме в запас.
3. Во время голодания или при сахарном диабете, т.е. тогда, когда углеводов нет или когда их утилизация нарушена, в качестве топлива используются белки. Во всех этих ситуациях аминокислоты теряют свои аминогруппы и превращаются в соответствующие α-кетокислоты, которые затем окисляются до СО2 и воды; частично это окисление идет через цикл лимонной кислоты.
В этом реферате будут описаны метаболические пути, по которым идет окислительное расщепление двадцати обычных аминокислот, входящих в состав белков. А также то, что у разных видов животных отщепляемый от аминокислот аммиак выводится из организма в различной химической форме.
Окисление аминокислот
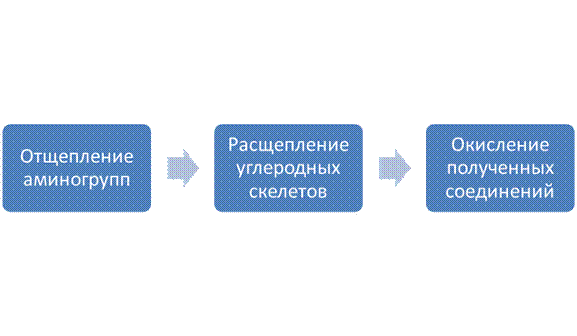
Окисление аминокислот происходитв несколько стадий. Сначала α-аминогруппы двадцати обычных L-аминокислот, обнаруживаемых в белках, отщепляются на одной из стадий окислительного расщепления аминокислот. Если эти аминогруппы не используются повторно для синтеза новых аминокислот или других азотсодержащих соединений, то они собираются в одной форме, превращаются в конце концов в один общий конечный продукт и в таком виде выводятся из организма. После удаления аминогрупп в реакциях трансаминирования с α-кетоглутаратом углеродные скелеты аминокислот подвергаются окислительному расщеплению и превращаются в соединения, способные включаться в цикл лимонной кислоты и окисляться в нем до CO2 и H2O.
Отщепление аминогрупп
Отщепление α-аминогрупп от большей части L-аминокислот катализируется ферментами, которые называются трансаминазами или аминотрансферазами. В таких ферментативных реакциях трансаминировання α-аминогруппа переносится от аминокислоты на α-углеродный атом α-кетоглутарата, в результате чего образуется α-кетоаналог исходной аминокислоты и L-глутамат, представляющий собой продукт аминирования
α-кетоглутарата.
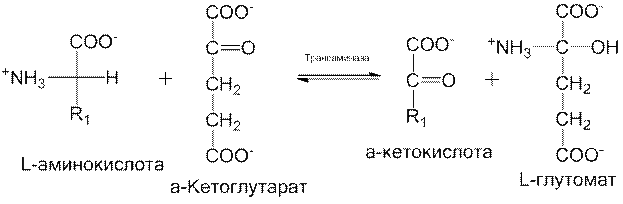
Надо отметить, что реального дезаминирования, т.е. потери аминогрупп, в таких реакциях не происходит, поскольку дезаминирование α -аминокислоты сопровождается аминированием α-кетоглутарата. Смысл трансаминирования состоит в его коллекторной функции, иными словами, в том, что аминогруппы от многих разных аминокислот собираются в одной форме в виде L-глутаминовой кислоты. Таким образом, катаболизм различных аминокислот приводит в конечном итоге к одному-единственному продукту.
Итак, общим акцептором, принимающим аминогруппу от большинства аминокислот, является α-кетоглутарат. Образовавшийся L-глутамат служит для того, чтобы направлять аминогруппы на определенные биосинтетические пути и в ту конечную последовательность реакций, посредством которой образуются продукты азотистого обмена, выводимые затем из организма.
Расщепление углеродных скелетов
В состав белков входит 20 обычных аминокислот, различающихся своими углеродными скелетами. Соответственно существует и 20 различных катаболических путей для их расщепления. Из общего количества энергии, потребляемой организмом, на долю всех этих путей приходится не более 10%. Это значит, что участие каждой из аминокислот в общем метаболизме выражается в среднем величиной порядка 0,5%. Ясно, таким образом, что значение этих аминокислотных путей, взятых по отдельности, не может идти ни в какое сравнение со значением гликолиза или цикла лимонной кислоты. Поэтому не будем рассматривать их подробно. Дело в том, что 20 различных катаболических путей, по которым идет расщепление аминокислот, в конечном счете сливаются и приводят всего лишь к пяти продуктам, которые затем поступают в цикл лимонной кислоты и здесь окисляются полностью до СО2 и Н2О.
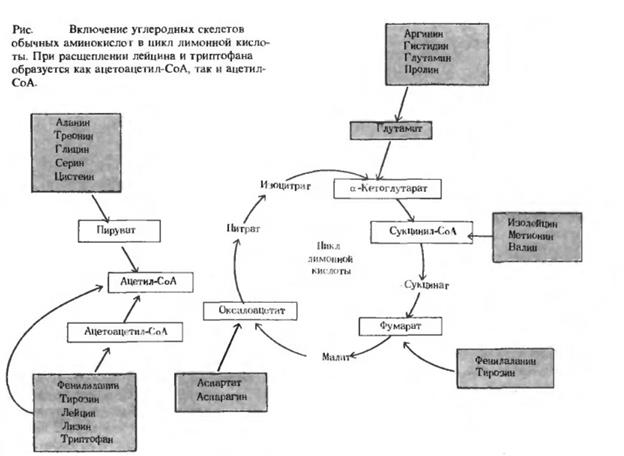
На рисунке видно, что углеродные скелеты десяти аминокислот разрушаются с образованием ацетил-СоА. Пять аминокислот превращаются в α-кетоглутарат, три в сукцинил-СоА, две в оксалоацетит и две в фумарат. Индивидуальные пути для 20 аминокислот мы объединим здесь в схемы, в каждой из которых эти пути будут вести к определенному продукту, способному включиться в цикл лимонной кислоты. (Углеродные атомы, которым предстоит включиться в цикл лимонной кислоты, выделены на схемах красным.) Некоторые ферментативные этапы этих путей, представляющие особый интерес либо из-за своеобразного механизма реакции, либо из-за того, что они важны с медицинской точки зрения, мы обсудим отдельно.
Десять аминокислот превращаются в результате расщепления в ацетил-СоА
Углеродные скелеты десяти аминокислот, разрушаясь, превращаются в ацетил-СоА, непосредственно включающийся в цикл лимонной кислоты. Пять из этих десяти аминокислот расщепляются до ацетил-СоА через пируват; другие пять превращаются сначала в ацетоацетил-СоА, а затем уже этот последний расщепляется до ацетил-СоА (рис. 19-4). Через пируват идет расщепление аланина, цистеина, глицина, серина и треонина (рис. 19-5). Аланин превращается в пируват непосредственно в реакции грансаминирования с а-кетоглутаразом. Четырехуглеродная аминокислота треонин расщепляется с образованием двухуглеродной аминокислоты глицина, который может подвергаться дальнейшим превращениям по двум путям. На одном из них глицин сначала превращается в серин (трехуглеродную аминокислоту) в результате ферментативного присоединения гидроксиметильной группы, переносчиком которой служит кофермент тетрагидрофолат (рис. 19-6). Из предыдущего мы уже знаем (раэд. 10.10), что тетрагидрофолат выступает в роли переносчика одноуглеродных групп, таких, как метильная. формильная, гидроксиметильная и формиминогруппа (рис. 19-6). Однако главный путь катаболизма глицина ведет через другую реакцию, также требующую присутствия теграгидро- фолата. В этой реакции происходит окис ительное растепление глицина до С02, NH4 и метиленовой группы (• СН2—), которая присоединяется к тетрагидрофолату. Реакция легко обратима; катализируется она глицин-синтазой:
H3N—СН2—СОО~ + FH4 -ь + NAD+
^ N5,N10-Meranen-FH4 + С02 +
+ NADH + nh;.
На этом катаболическом пути два углеродных атома глицина не поступают в цикл лимонной кислоты. Один из них отщепляется в виде С02, а второй используется для образования метиленовой группы N5N1 °-метилентетра1 идро- фолата (рис. 19-6), который служит донором метиленовых групп в некоторых биосинтетических реакциях.
Фрагменты углеродного скелета фенилаланина, тирозина, лизина, триптофана и лейцина превращаются в ацетоаце- тил-СоА, из которого затем образуется ацетил-СоА (рис. 19-7).
Особого внимания заслуживают в этой группе два катаболических пути. Путь, ведущий от триптофана к ацетил-СоА, самый сложный в аминокислотном катаболизме животных тканей: он включает 13 этапов. Некоторые промежуточные продукты катаболизма триптофана служат предшественниками в биосинтезе других важных биомолекул, например нейрогормона серотонина или такого витамина, как никотиновая кислота (рис. 19-8). Таким образом, путь, по которому идет катаболизм триптофана, имеет несколько ответвлений, что создает возможность для образования ряда других продуктов из единственного предшественника - триптофана.
Второй интересный путь это путь, ведущий от фенилаланина (рис. 19-9). Фенилаланин и продукт его окисления тирозин распадаются на два фрагмента; оба они могут вступать в цикл лимонной кислоты, хотя и на разных уровнях. Четыре из девяти углеродных атомов фенилаланина и тирозина дают свободный ацетоацетат, который затем превращается в ацетил-СоА (рис. 19-7). Второй четырехуглеродный фрагмент тирозина и фенилаланина превращается в фумарат промежуточный продукт цикла лимонной кислоты (см. ниже). Таким образом, восемь из девяти атомов этих аминокислот поступают в цикл лимонной кислоты; девятый атом отщепляется в виде С02. Фенилаланин (после гидрок- силирования, т.е. через тирозин) также в конечном счете используется как предшественник гормона щитовидной железы тироксина и двух гормонов, вырабатываемых мозговым веществом надпочечников -адреналина и норадреналина (гл. 25).
Пять аминокислот превращаются в а-кегоглутарат
Углеродные скелеты пяти аминокислот поступают в цикл лимонной кислоты через а-кетоглутарат; к этим аминокислотам относятся аргинин, гистидин, глутаминовая кислота, глутамин и пролин
Три аминокислоты превращаются в сукцинил-СоА
Углеродные скелеты метионина, изолейцина и валина расщепляются в реакциях, приводящих в конечном счете к сук- цинил-СоА, т. е. к одному из промежуточных продуктов цикла лимонной кислоты (рис. 19-12). Превращения изолейцина и валина протекают сходным образом. Обе эти аминокислоты претерпевают трансаминирование с последующим окислительным декарбоксилирова- нием образовавшихся а-кетокислот. В янтарную кислоту включаются четыре из пяти углеродных атомов валина и три из шести углеродных атомов изолейцина.
Окислительное декарбоксилирование трех а-кетокислот, являющихся продуктами дезаминирования валина, изолейцина и лейцина, катализируется одним и тем же ферментным комплексом - дегидрогеназой а-кетокислот. У некоторых людей вследствие генетической аномалии этот фермент неактивен, и потому а- кетокислоты накапливаются у них в крови и попадают в мочу, что придает ей специфический запах, из-за которого данную болезнь называют болезнью кленового сиропа. Эта довольно редкая аномалия приводит к нарушению нормального развития мозга и при отсутствии лечения-к смерти в раннем возрасте. Лечение сводится к строгой диете, к возможно более полному исключению из рациона трех обычных аминокислот-валина, изо- лейцина и лейцина. Стоит такое «лечение» чрезвычайно дорого.
Из фенилаланина и тирозина образуется фумарат
Выше мы отмечали, что из фенилаланина и тирозина образуется по два четырехуглеродных продукта - ацетоацетат и фумарат (рис. 19-9). Ацетоацетат поступает в цикл лимонной кислоты в форме ацетил-СоА, а фумарат сам является промежуточным продуктом этого цикла.
Оксалоацета гный путь
Углеродные скелеты аспарагина и аспарагиновой кислоты поступают в конечном счете в цикл лимонной кислоты через оксалоацетат (рис. 19-4). Фермент аспарагиназа катализирует гидролиз аспарагина с образованием аспартата
Аспарагин + Н20 -*
Аминогруппа аспартата передается затем а-кетоглутарату в реакции трансами- нирования, продуктом которой является глутамат
Аспартат + а-Кстоглутарат
Оксалоацетат 4- Глутамат.
Остающийся углеродный скелет аспартата, в форме оксалоацетата, включается в цикл лимонной кислоты.
Итак, мы познакомились теперь с тем, каким образом 20 различных аминокислот расщепляются после дезаминирования в результате дегидрирования, де- карбоксилирования и других превращений до пяти известных метаболитов, в виде которых фрагменты их углеродных скелетов могут включаться в цикл лимонной кислоты. Здесь эти фрагменты окисляются уже полностью - до двуокиси углерода и воды. Во время переноса электронов в процессе окислительного фосфорилирования синтезируется АТР. Таким путем аминокислоты вносят свой вклад в общее обеспечение организма энергией.
19.10. Некоторые аминокислоты могут превращаться в глюкозу, а другие в кетоновые тела
Мы уже знаем, что пять аминокислот, распадаясь, превращаются в конце концов в ацетоацетил-СоА. В печени из этих аминокислот могут образовываться кетоновые тела, потому что ацетоацетил- СоА способен превращаться в ацетоацетат и Р-гидроксибутират (разд. 18.10). Пять аминокислот, о которых идет речь, носят поэтому название кетогенных (табл. 19-2). Их способность образовывать кетоновые тела проявляется особенно отчетливо в случае нелеченого сахарного диабета; в печени при этом вырабатываются большие количества кетоновых тел, источником которых служат помимо жирных кислот еще и кето- генные аминокислоты.
Таблица 19-2. Глюкогенные и кетогснные аминокислоты
| Глюкогенные | Пролин |
| Аланин | Серин |
| Аргинин | Треонин |
| Аспарагин | Триптофан |
| Аспарагиновая | Цистеин |
| кислота | Кетогенные |
| Валин | Лейцин |
| Г лутаминовая | Лизин |
| кислота | Триптофан |
| Гдутамин | Кетогенные и глю- |
| Глинин | ко генные |
| Гистидин | Тирозин |
| Метионин | Фенилаланин |
Пятнадцать аминокислот, распадающихся с образованием а-кетоглутарата, сукцината и оксалоацетата, могут превращаться в глюкозу и гликоген по пути, описанному в гл. 20. Их называют глюкогенными аминокислотами (табл. 19.2). Между кетогенными и глюкогенными аминокислотами нет четкой границы, поскольку две аминокислоты (фенилаланин и тирозин) принадлежат одновременно и к той, и к другой группе. Некоторые из аминокислот, превращающихся в пиру- ват, в частности аланин, цистеин и серин, также потенциально способны образовывать ацетоацетат через ацетил-СоА, особенно у больных сахарным диабетом (разд. 18.10, 19.3).








