Химические свойства и способы получения углеводородов
Задания для внеаудиторной работы
1. Что такое гомологические ряды и их значение в органической химии?
2. Что называется первичным, вторичным, третичным и четвертичным углеродными атомами?
3. Какие реакции свойственны предельным углеводородам?
4. В чем заключается правило Марковникова? Напишите уравнение реакции взаимодействия пропена с HCl.
5. Особенности окисления алкенов в нейтральной и кислой средах. Напишите уравнения реакций окисления пропена в нейтральной и кислой средах.
6. Напишите уравнения реакций присоединения водорода, хлора, хлороводорода к ацетилену. В каком случае нужно использовать правило Марковникова?
7. Напишите уравнения реакций нитрования и бромирования бензола. Укажите условия.
8. Назовите соединения в соответствии с номенклатурой ИЮПАК.
1)
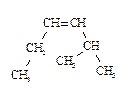
| 4)
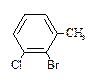
|
2)
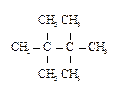
| 5)
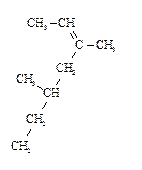
|
3)
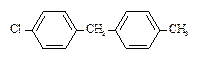
| 6)
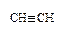
|
Лабораторная работа № 2 «Углеводороды. Химические свойства и качественный функциональный анализ»
Опыт 1. Химические свойства алканов
Отношение к окислению. В каждую из трех пробирок поместите по 1 капле любого алкана или смеси алканов (вазелиновое масло, петролейный эфир) и добавьте по 4 капле воды и 1 капле 2% перманганата калия. Затем в первую пробирку внесите 1 каплю концентрированного растворара гидроксида натрия, во вторую – 1 каплю концентрированной серной кислоты. Пробирки несколько раз энергично встряхните и отметьте, какую окраску имеет эмульсия в каждой пробирке. Содержимое каждой пробирки прокипятите в течение нескольких минут. Происходит ли при этом изменение окраски?
Вопросы:
1. Сравните действие окислителей – перманганата калия в нейтральной, кислой и щелочной средах – при комнатной температуре и при нагревании.
2. На основании проделанного эксперимента сделайте вывод об отношении алканов к окислению.
Бромирование при облучении УФ-светом. В две кварцевые кюветы поместите по 3-4 мл любого алкана или их смеси, добавьте по 4-5 капель 5% раствора брома в тетрахлорометане и перемешайте. Одну кювету накройте колпачком из черной бумаги. Поставьте обе кюветы под источник УФ-света (например, кварцевую лампу). Через 3-4 минуты облучения снимите черный колпачок и сравните окраску растворов в обеих кюветах.
Вопросы:
1. Почему для проведения бромирования алканов необходимо облучение УФ-светом?
2. Объясните, почему в закрытой черным колпачком кювете реакционная смесь не обесцвечивается?
3. Напишите схему реакции бромирования алкана. По какому механизму протекает эта реакция?
Опыт 2. Получение и химические свойства этилена
Получение. В сухую пробирку налейте 2-3 мл готовой смеси этилового спирта и концентрированной серной кислоты, бросьте несколько кусочков “кипелок” для равномерного кипения. Закройте пробирку пробкой с газоотводной трубкой и закрепите пробирку в лапке штатива под небольшим углом. Нагрейте пробирку сначала медленно, затем, усильте нагревание. Временно отставьте горелку и прекратите нагревание.
Бромирование. Во вторую пробирку поместите немного бромной воды. Опустите в нее газоотводную трубку так, чтобы конец трубки был погружен в бромную воду. Осторожно нагрейте реакционную смесь. Как только бромная вода обесцветится, уберите вторую пробирку.
Окисление. В третью пробирку поместите немного 2% раствора перманганата калия. Опустите в нее конец газоотводной трубки. Нагрейте пробирку с реакционной смесью. Обратите внимание на изменение окраски раствора в третьей пробирке.
Вопросы:
1. Напишите схемы реакций получения, бромирования и мягкого окисления этилена.
2. О чем свидетельствует наблюдаемое в опыте обесцвечивание бромной воды и раствора перманганата калия?
Опыт 3. Получение и химические свойства ацетилена
Получение. В первую пробирку поместите кусочек карбида кальция, добавьте немного капель воды. Сразу же начинается выделение газообразного ацетилена. Закройте пробирку пробкой с газоотводной трубкой и закрепите в штативе.
Бромирование. Во вторую пробирку поместите немного бромной воды и опустите в нее конец газоотводной трубки. Происходит обесцвечивание бромной воды.
Окисление. В третью пробирку поместите немного 2% раствора перманганата калия, и опустите в нее конец газоотводной трубки. Происходит обесцвечивание раствора перманганата калия.
Вопрос:
Напишите схемы реакции получения ацетилена и качественных реакций, выполненных в этом опыте.
Опыт 4. Нитрование аренов
Нитрование бензола. В сухую пробирку налейте 3 мл нитрующей смеси (H2SO4:HNO3 = 2:1). Прилейте к ней 1 мл бензола в 3 приема, хорошо перемешивая смесь после каждого прибавления. Если смесь сильно разогревается после очередного прибавления бензола и перемешивания, ее следует охладить погружением пробирки в воду. Над нитрующей смесью появляется слой нитробензола, окрашенного в желтый цвет. Вылейте содержимое пробирки в стаканчик с холодной водой, избыток кислоты при этом растворяется в воде, нитробензол же выделяется на дне стакана в виде маслянистых капель, окрашенных в слабо-желтый цвет. Нитробензол имеет запах горького миндаля.
Вопросы:
1. Напишите схему реакции получения нитробензола из бензола.
2. Объясните ориентирующее влияние нитрогруппы и напишите реакцию последующего нитрования бензола.
Опыт 5. Окисление аренов
Окисление бензола и толуола. В две пробирки налейте по 0,5 мл бензола и толуола и прибавьте к ним по 2 мл раствора перманганата калия. Встряхните смесь и отметьте, что наблюдается при этом. Затем прибавьте в каждую пробирку такой же объем 10% серной кислоты и отметьте изменение окраски в одной из пробирок.
Вопрос:
Напишите схемы реакций окисления аренов. В чем состоит отличие?
Опыт 6. Сравнение свойств алканов различного строения. Налейте в одну пробирку 0,5 мл петролейного эфира, в другую – 0,5 мл гептана. В каждую пробирку добавьте по 2-3 капли брома в тетрахлорметане.
Встряхните пробирки, опишите наблюдаемую ораску. Нагрейте обе пробирки в стаканчике с горячей водой. Опишите и объясните наблюдения (схема реакции).
Петролейный эфир – смесь алканов, содержащая алканы разветвленного строения, например, 2-метилбутан.
Опыт 7. Сравнительные свойства алканов и алкенов. Налейте в две пробирки по 0,2-0,3 мл бромной воды, в одну пробирку добавьте 0,5 мл петролейного эфира, в другую – 0,5 мл бензина. Пробирки встряхните и опишите наблюдения. Бензин содержит 2,4,4-триметилпентен-1.
Опыт 8. Влияние заместителей на реакционную способность аренов. Налейте в 2 пробирки по 0,5 мл бензола и толуола, добавьте в каждую пробирку по 2-3 капли брома в тетрахлорметане. Встряхните пробирки, опишите наблюдения и объясните их (схема реакции). Допускается кратковременный нагрев пробирок в стаканчике с горячей водой.
Подпись преподавателя: Дата:
ЗАНЯТИЕ 7
Алкадиены. Терпены. Стероиды
Задания для внеаудиторной работы
1. Алкадиены, их строение, классификация, номенклатура, изомерия.
2. Химические свойства алкадиенов.
3. Каучуки, их строение, получение, свойства.
4. Опишите схему синтеза каучука по Лебедеву.
5. Изопреноиды, их строение и нахождение в природе.
6. Классификация терпенов.
7. Каротиноиды, их строение, представители, связь с витаминами.
8. Стероиды, представители, биологическое значение.
Задания для аудиторной работы
1. Напишите формулы изомеров пентадиена и укажите типы связи (кумулированные, сопряженные, изолированные).
2. Напишите структурные формулы всех диеновых углеводородов образующихся при дегидрировании 2-метилпентана, и назовите их. Укажите, к какому типу диеновых углеводородов относится каждый изомер.
3. Предложите метод синтеза хлорпропенового каучука исходя из ацетилена и любых неорганических реагентов.
4. Осуществите превращения, отвечающие следующей схеме:
а) карбид кальция → ацетилен → этанол → 1,3-бутадиен → 1,4-дибромбутен-2
б) метан → ацетилен → винилацетилен → дивинил → 1,4-дибромбутен-2 → 1,4-дибромбутан → циклобутан
5. Установите структурную формулу углеводорода состава С8Н14, при окислении которого образуются ацетон СН3-СО-СН3 и щавелевая кислота НООС-СООН.
6. Может ли диеновый углеводород лимонен – главная составная часть масел, извлекаемых из кожуры лимона, апельсина – вступать в реакцию 1,4-присоединения. Свой ответ аргументируйте.
7. В пяти неподписанных газометрах находятся циклопропан, пропан, пропен, пропин, бутадиен-1,3. С помощью каких химических реакций можно идентифировать содержимое каждого газометра?
ЗАНЯТИЕ 7
Контрольная работа «Химические свойства и способы получения углеводородов»
Вопросы для подготовки к контрольной работе
1. Алканы. Номенклатура, химические свойства, способы получения.
2. Алкены. Номенклатура, химические свойства, способы получения.
3. Алкины. Номенклатура, химические свойства, способы получения.
4. Арены. Номенклатура, химические свойства, способы получения.
5. Диеновые углеводороды. Номенклатура, химические свойства, способы получения.
6. Галогенпроизводные углеводородов. Номенклатура, химические свойства, способы получения.
Задания для внеаудиторной работы
1. Осуществите следующий переход: циклопропан → циклобутан.
2. Осуществите следующие превращения:
КОН (спирт) Cактивир., Т HNO3 [H2SO4] Br2, AlBr3
1,2-дихлорэтан----------------->A --------------> Б------------------> В -------------> Г
3. Сравните химические свойства пропена и циклопропана, отметьте сходство и различие. Как относятся эти соединения к действию следующих реагентов: а) Br2 (свет), б) Br2 [CCl4], в) HBr г) KMnO4 (Н2О, 0оС), д) Н2 (Ni), е) H2SO4? Где есть взаимодействие, приведите схемы реакций.








