Вопросы для проверки знаний
1. Что изучает коллоидная химия?
2. Какие примеры указывают на особую роль поверхности дисперсной системы?
3. Какая из фаз обладает более высокой степенью раздробленности - дисперсная фаза или дисперсионная среда?
4. Можно ли считать масляную пленку на поверхности воды частицей дисперсной фазы?
5. Относятся ли высокодисперсные системы к коллоидным растворам или золям?
6. В чем принципиальное различие между лиофильными и лиофобными золями?
7. Какой основной признак отличает свободно- и связнодисперсные системы?
Упражнения
1. Приведите аргументы, подтверждающие или опровергающие утверждение, что коллоидная химия изучает наиболее распространенное в природе состояние тел.
2. Рассчитайте, во сколько раз увеличится поверхность газового пузырька в воде, если при своем движении вверх он разбился на 1000 мелких одинаковых по размеру пузырьков. Различием гидравлического давления можно пренебречь.
3. В креме после бритья капли эмульсии имеют размер d = 5×10-6 м. Вычислите удельную поверхность дисперсной фазы, если известно, что плотность капель эмульсии r = 1.1×103 кг/м3
4. На электростанции каменный уголь, измельченный до порошка с размером частиц d = 1×10-6 м, сжигают в пламени форсунки. В таких условиях повышается эффективность полного сгорания частичек угля. Вычислите, во сколько раз увеличивается удельная поверхность при дроблении 1 кг каменного угля, имеющего плотность r = 1.3×103 кг/м3.
ТЕМА 2
ФИЗИКО-ХИМИЧЕСКАЯ ХАРАКТЕРИСТИКА ПОВЕРХНОСТНОГО СЛОЯ
В любой дисперсной системе на границе раздела фаз
жидкость ï газ,
жидкость ï твердое тело,
твердое тело ï газ
проявляются такие свойства, как поверхностное натяжение, адсорбция - концентрирование вещества на поверхности, адгезия - прилипание соприкасающихся поверхностей, формирование на поверхности двойного электрического слоя. Рассмотрим вышеуказанные свойства дисперсных систем.
2.1. Поверхностное натяжение
Известно, что шар имеет наименьшую площадь поверхности, по сравнению с любой фигурой, имеющей такой же, как шар, объем. При плавлении небольшого кристалла льда происходит самопроизвольное образование капли воды, поверхность которой представляет сферу (рис. 3).

Рис. 3. Изменение геометрических параметров тела при самопроизвольном превращении кристалла льда (куб) в каплю воды (шар)
Самопроизвольное сокращение площади поверхности объясняется проявлением энергии поверхностного натяжения (рис. 4).
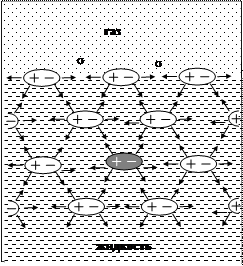 |
Рис. 4. Модель межмолекулярного взаимодействия на поверхности раздела фаз газ-жидкость и в объеме жидкости. Проявление поверхностного натяжения s
Поверхностный слой молекул жидкости испытывает действе сил притяжения со стороны молекул жидкой и газовой фаз. Притяжение со стороны газовой фазы пренебрежимо мало в силу небольшой концентрации вещества газовой фазы, поэтому равнодействующая сил притяжения на поверхности направлена внутрь жидкой фазы (рис. 4). Внутри жидкости силы, действующие на молекулы со стороны окружения, взаимно компенсированы. В этом можно убедиться на примере диполя, выделенного темным цветом (рис. 4).
Нереализованное притяжение со стороны газовой фазы на поверхности жидкости количественно оценивается энергией поверхностного натяжения s.
Критерием самопроизвольного изменения поверхности термодинамической системы является уменьшение функции Гиббса. При постоянном давлении и температуре (р,Т = const):
dG = s × ds < 0, (2.1)
где s – удельное поверхностное натяжение, которое в дальнейшем будем называть просто поверхностным натяжением; ds – изменение площади поверхности дисперсной фазы. Из уравнения (2.1) следует
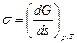 или
или
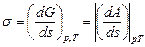 ,
,
где А – работа, совершаемая системой:
dA = s ds . (2.2)
Интегрируем уравнение (2.2):
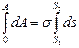
A = s△s . (2.3)
При расчете работы A, затраченной на изменение единицы площади поверхности (△s =1), получаем:
A = s Дж/м2








