Химические свойства неметаллов
01.04
Тема. Положение неметаллов в ПСХЭ. Свойства неметаллов.
Домашнее задание. § 36, с. 172 № 2 (а,б)
Ход урока
Неметаллы расположены в основном в правом верхнем углу Периодической системы, условно ограниченном диагональю бор-астат. Самым активным является фтор.
В периоде заряд ядра атома НеМе постепенно растет, а размер атома уменьшается. При этом существует высокая способность к присоединению электрона.
При этом преобладают окислительные свойства. А у НеМе, которые расположены в основной подгруппе, чем меньше радиус атома, тем сильнее притягиваются внешние электроны. Значит здесь преобладают восстановительные свойства. 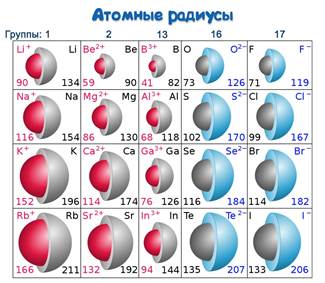
Определите, окислителем или восстановителем является сера в следующих реакциях:
H2+S0=H2S-2 S — окислитель
2S+4O2 + O2 → 2S+6O3 S — восстановитель
Химические свойства неметаллов
Неметаллы ввиду своего строения могут проявлять как окислительные и восстановительные свойства.
1. Окислительные свойства.
1. Взаимодействие неМе с Ме
2Na + Cl2 = 2NaCl;
2Al + 3S = Al2S3
2. Взаимодействие между собой
H2 + F2 = 2HF;
N2 + H2 = NH3
Неметаллы реагируют с водородом с образованием летучих водородных соединений Н2 – восстановитель.
H2 + S == H2S (при t0до 3000)
3H2 + N2 == 2NH3 (P, t0, kat)
3.С некоторыми сложными веществами
4NH3 + 5O2 = 4NO + 6H2O,
2FeCl2 + Cl2 = 2 FeCl3.
3Сl2+ 6KOH = 5KCl + KClO3 +3H2O
2. Восстановительные свойства
Фтор не проявляет восстановительных свойств. По отношению к нему все неметаллы проявляют восстановительные свойства. Все неметаллы будут восстановителями в реакциях с кислородом (за исключением фтора)
4P + 5O2 = 2P2O5
S+ 3F2 = SF6
S+O2 = SO2
При химических взаимодействиях неметаллы проявляют свойства как окислителей, так и восстановителей. Большинство неметаллов реагируют с кислородом с образованием оксидов; О2 – окислитель
2H2 + O2 = 2H2O + Q
S + O2 = SO2 + Q
C + O2 = CO2 + Q
4P + 5O2 = 2P2O5 + Q
N2 + O2 = 2 NO – Q
Наиболее сильные восстановительные свойства имеют неметаллы стоящие в ряду электроотрицательности далеко от фтора. Вам уже известно что водород, углерод и кремний хорошо восстаноавливают металлы из их оксидов.
C + ZnO = Zn + CO(t)
H2 + CuO = Cu + H2O(t)
Si + 3H2O = H2SiO3 + 2H2 (при очень выс. t)
Так же водород способен восстанавливать альдегиды и кетоны до соответствующих спиртов.
СН3СОН + Н2 = СН3СН2ОН
Альдегид спирт (этанол) имеет функциональную группу –ОН гидроксогруппу
СН3СОСН3 +Н2= СН3СНОНСН3
Кетон спирт
(ацетон)
1. СО2 + С = 2СО (при высокой температуре)
2. 4NH3 + 3O2 = 2N2 +6H2O (обязательно без катализаторов)
3. Fe2O3 + 3Mg = 2Fe +3MgO (термит)
4. 2Fe2O3 + 3C = 4Fe + 3CO2 (компонент доменного процесса)
5. CaCl2 + Na2CO3 = CaCO3↓ +2NaCl (в водном растворе)
Образец оформления Домашнего задания с. 172 № 2 (а,б)
1 2 3 4 5
Zn → ZnO → ZnCl 2 → Zn ( OH )2 → ZnO → Zn
1) 2Zn + O2 = 2ZnO
оксид
цинка
2) ZnO + 2HCl = ZnCl2 + H2O
хлорид вода
цинка
3) ZnCl2 + 2KOH = Zn(OH)2 + 2KCl
гидроксид хлорид
ᵗ цинка калия
4) Zn(OH)2↓ = ZnO + H2O
оксид вода
цинка
5) ZnO + H2 = Zn + H2O
Цинк вода








