5. Определить молярную массу и молярную массу эквивалента_ Н2SO4___.
ВГМХА, 2013-2014 уч. год. Модуль корректирующий. Основные понятия, законы и классификации общей химии.
Практические контрольные задания, вариант___0______
1. Какую высшую и низшую степень окисления проявляет водород, углерод, хлор, сера, азот? Почему? Напишите формулы веществ: 1) цинк, 2) сера_кристаллическая, 3) сера газообразная восьмиатомная, 4) азот, 5) озон, 6) оксид кальция (негашёная известь), 7) оксид кремния (кварц, горный хрусталь, аметист, сердолик, агат, тигровый (кошачий, бычий) глаз, яшма), 8) оксид железа (III) (корунд, красный железняк, гематит), 9) оксид цинка (цинковые белила) , 10) оксид титана (IV) (титановые белила), 11) оксид водорода (вода), 12) оксид углерода (IV) (углекислый газ, сухой лёд), 13) оксид углерода (II) (угарный газ), 14) перекись водорода (гидропирит), 15) гидрид азота (аммиак), 16) гидрид фосфора (фосфин), 17) гидрид кальция, 18) азидоводород, 19) циановодород (синильная кислота), 20) фтороводород (плавиковая кислота), 21) гидроксид натрия (едкий натр, каустическая сода, каустик), 22) гидрооксид кальция (гашёная известь, пушонка), 23) (орто-)борат кальция, 24) декагидрат тетрабората натрия (бура, тетраборат натрия десятиводный), 25) карбонат кальция (мел, известняк, кальцит, жемчуг, гравий, кораллы, ракушечник), 26) карбонат натрия (кальцинированная сода, натрий угольнокислый), 27) гидрокарбонат натрия (питьевая сода, натрий угольнокислый кислый), 28) оксалат натрия, 29) карбид магния, 30) цианид железа (III), 31) роданид железа (II), 32) ацетат висмута (Ш), 33) нитрат алюминия (алюминий азотнокислый), 34) нитрит серебра (I), 35) азид магния, 36) фосфид кальция (флюорит), 37) нитрид магния, 38) (орто-)фосфат кальция, 39) (мета-)фосфат кальция, 40) фосфит натрия, 41) фосфид аммония, 42) дигидрофосфат кальция, 43) дигидрат сульфата кальция (гипс, «роза пустыни», сульфат меди двуводный), 44) пентагидрат сульфата меди (II) (медный купорос, сульфат меди пятиводный), 45) декагидрат сульфата натрия (глауберова соль, горькая соль, сульфат натрия десятиводный), 46) карбонат гидроксомеди (I), 47) карбонат гидроксомеди (II) (малахит), 48) сульфит гидроксомагния, 49) сульфид железа (II), 50) сульфид железа (IV) (пирит, персульфид железа (II)), 51) додекагидрат сульфата алюминия-калия (алюмокалиевые квасцы), 52) сульфид ртути (II) (киноварь), 53) сульфид цинка (цинковая обманка, сфалерит), 54) фторид бора (бор фтористый), 55) перхлорат аммония, 56) хлорат калия (бертолетова соль), 57) хлорит натрия (текстон), 58) гипохлорит кальция (содержится в хлорной, белильной извести), 59) хлорид натрия (каменная, поваренная соль, натрий хлористый), 60) перманганат калия (марканцовка, калий марганцевокислый), 61) манганат калия, 62) силикат марганца (II) (роданит), 63) силикат алюминия (гранат), 64) основной силикат кальция–железа-магния (нефрит Ca(Fe,Mg)5[Si4O11]2(OH)2), 65) гидратированный основной фосфат меди-алюминия (бирюза CuAl6 · [РО4] · 4[ОН]8·5Н2О).
2. Назвать комплексные соединения, указав тип каждого, комплексообразователь, лиганд, внешнюю и внутреннюю сферу, координационное число:
Nа 2[Ве(ОН)4]; К3[Fе(СN)6](жёлтая кровяная соль); [Сd(NH3)4]Cl2; [Сr(Н2О)4 Cl2]Cl ; К2[Cu(СN)4] ; [Рt(NH3)2Cl2] ; [Аg(NH3)2] ; К2[Zn(ОН)4] ; Nа3[Аl(ОН)6] .
3. С каким из ниже перечисленных веществ будет взаимодействовать __Na2O__: оксид серы (IV), оксид калия, гидроксид магния, соляная кислота, оксид цинка? Напишите уравнения соответствующих реакций. Назовите продукты реакции.
4. Пойдёт ли ионообменная реакция между__Na2CO3__ и __Н2SO3__? Напишите молекулярное, ионные полное и краткое уравнения.
5. Определить молярную массу и молярную массу эквивалента_ Н2SO4___.
6. Какова масса _10__ молей и __6,02 ·1023__ молекул __H2__?
7. Сколько молекул содержится в __32___ г __O2__?
8. а) Какой объем занимают _56__ г _N2__при н.у. б) Какой объем занимают _56__ г _N2_ при 20 ◦С, давлении __770__ мм. рт. ст. (760 мм. рт .ст.= 1 атм = 101,3 кПа)?
9. Определить молярную массу эквивалента металла, и металл (при его валентности I) если при сгорании __0,432__ его грамм образуется__0,464___ грамм оксида.
10. Оксид марганца содержит 22,56 % кислорода. Вычислите молярную массу эквивалента марганца в оксиде и составьте формулу.
11.Масса литра азота при нормальных условиях равна 1,251 г, а масса 250 мл неизвестного газа – 0,492 г. Определите молекулярную массу неизвестного газа, исходя: а) из его плотности по азоту; б) из молярного объема.
12.При н.у _300_ мл газа имеют массу_0,857_ г. Определите молярную массу газа, его плотность по _воздуху__.
13. Исходя из степени окисления йода и серы в соединениях Cr2(SO4)3; KJ; KJO3 ; Na2S и H2SO4 объясните, какие из них являются окислителями, какие восстановителями и какие могут проявлять как окислительные, так и восстановительные свойства?
14. Окисление или восстановление происходит при следующих превращениях: H2SO4 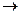 H2S; SO42-
H2S; SO42- 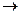 S2-; НClO4
S2-; НClO4 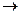 НCl; ClO4-
НCl; ClO4- 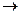 Cl-; ClO2-
Cl-; ClO2- 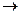 Cl2; Cr2O72-
Cl2; Cr2O72- 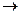 CrO32; MnO42-
CrO32; MnO42- 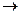 MnO4-?
MnO4-?
15. Написать уравнение реакции (уравнять схему превращения методом электронного баланса):
а) KMnO4 + K2SO3 + H2O 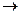 MnO2 + K2SO4 + KOH; б) NaCl + MnO2 + H2SO4
MnO2 + K2SO4 + KOH; б) NaCl + MnO2 + H2SO4 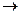 NaHSO4 + MnSO4 + Cl2 + H2O;
NaHSO4 + MnSO4 + Cl2 + H2O;
в) Zn + KNO2 + KOH + H2O 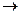 K2[Zn(OH)4] + NH3; г) Br2 + HClO + H2O
K2[Zn(OH)4] + NH3; г) Br2 + HClO + H2O 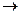 HBrO3 + HCl.
HBrO3 + HCl.
16. Указать, какие процессы происходят на электрохимически неактивных катоде и аноде, если электролизу подвергается расплав NaCl. Записать результат электрохимической реакции (вывод).
17. Определить ЕДС гальванического элемента Mg|Mg2+||Zn2+|Zn при Т=298◦К, конценрациях солей 1моль/л.








