Основа и суффиксы в названиях ненасыщенных и насыщенных гетероциклов.
| Число атомов в цикле | Азотсодержащие | без азота | ||
| ненасыщенные | насыщенные | ненасыщенные | насыщенные | |
| 3 | -ирин | -иридин | -ирен | -иран |
| 4 | -ет | -етидин | -ет | -етан |
| 5 | -ол | -олидин | -ол | -олан |
| 6 | -ин | ----* | -ин | -ан |
| 7 | -епин | ----* | -епин | -епан |
Примечание: * применяются дополнительные приставки пергидро-, тетрагидро- и т.д.; эти же приставки применяются часто и для других гетероциклов.
Примеры:

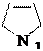
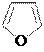
 43
43


 N 5 2 N
N 5 2 N
H H H
азол азолин-3 азолидин оксол оксолан тиофан (пиррол) (пирролин-3) (пирролидин) (фуран) (тетраги- (тетраги-

 дрофуран) дротиофен)
дрофуран) дротиофен)


 3
3
2

 N N 1
N N 1
H H
3 3 N
2 2 N
1 1
азин пергидропиридин диазин-1,3 оксазол-1,3 диазин-1,3
(пиперидин)
5) В названиях изомерных соединений, которые различаются положением двойных связей, дополнительно обозначается атом, который не участвует в образовании двойных связей: этот атом имеет «дополнительный водород», его обозначают знаком Н.
Пример:
4

 3 3
3 3
2 2
1 1
2Н-оксин 4Н-оксин
(α-пиран) (γ-пиран)
Данные правила показывают лишь некоторые общие основы и не являются исчерпывающими.
3. Электронное строение ароматических гетероциклов.
Химический сдвиг протонов при атомах углерода цикла, который составляет около 8 м.д. (6-9 м.д.), используется как экспериментальный критерий ароматического строения гетероциклов.
Ароматическое строение гетероциклов соответствует известным для аренов признакам: 1) циклический σ-скелет; 2) замкнутая (циклическая) сопряженная π-система, которая обеспечивается плоским строением цикла и sp2-гибридизацией всех атомов в цикле; 3) число π-электронов (N) соответствует правилу Хюккеля N=4n+2, где n недробное число; по числу π- электронов ароматические гетероциклы изоэлектронны бензолу или другим аренам (т.е. число их π-электронов равно 6, как у бензола, или 10, как у нафталина, и т.д.).
Примеры:




 N O N
N O N
H H
6 πẽ 6 πẽ 6 πẽ 10 πẽ
6=4n+2 10=4n+2
n=1 n=2
Особенностью строения ароматических гетероциклов является то, что в образовании ароматической π-системы соединения принимает участие гетероатом.
 Пиррольный гетероатом в состав π –системы предоставляет пару электронов на р-орбитали, которая участвует в сопряжении и оказывается таким образом делокализованной. Использование этой пары электронов для других процессов без разрушения ароматического строения соединения невозможно.
Пиррольный гетероатом в состав π –системы предоставляет пару электронов на р-орбитали, которая участвует в сопряжении и оказывается таким образом делокализованной. Использование этой пары электронов для других процессов без разрушения ароматического строения соединения невозможно.
Такое электронное строение в составе электронейтральной молекулы могут иметь большинство гетероатомов. Поэтому известны пятичленные ароматические гетероциклы с одним гетероатомом разной природы – азот-, кислород-, серусодержащие и другие.
Пиррольное и пиридиновое строение гетероатома в цикле:
сопряжение
s
s
p-связь

 s
s
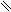 s s
s s
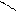 > N N
> N N
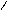
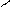
 O
O
пиррольный пиридиновый
гетероатом гетероатом
Пиридиновый гетероатом имеет двойную связь, на образование π-связи он предоставляет р-орбиталь с одним электроном. Неподеленная пара пиридинового гетероатома занимает гибридную орбиталь в плоскости цикла. Поэтому неподеленная пара электронов пиридинового гетероатома не участвует в сопряжении и образовании ароматической π-системы, она локализована на гетероатоме.
Пиридиновое строение в электронейтральной молекуле может иметь атом азота; для атомов кислорода и серы это невозможно. Поэтому ароматические шестичленные гетероциклы, ароматические пятичленные гетероциклы с двумя и более гетероатомами в качестве пиридинового гетероатома имеют только азот.
Примеры:
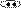
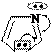


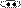 N N N O H
N N N O H
В составе ионов пиридиновое строение могут иметь и другие гетероатомы, например, кислород катиона пирилия. Существование такого катиона энергетически обосновано его ароматическим строением.
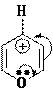 Строение катиона пирилия:
Строение катиона пирилия:
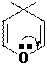
 H H
H H
 |
g-пиран; нет ароматического строения
O
 катион пирилия имеет ароматическое строение
катион пирилия имеет ароматическое строение





 Ароматичность (термодинамическая устойчивость) гетероциклов неодинакова и выражена меньше, чем у бензола, так как влияние гетероатома в цикле делает распределение электронов неравномерным. С увеличением электроотрицательности гетероатома ароматичность гетероциклического соединения уменьшается. Например, уменьшение энергии резонанса в ряду бензол → пиридин → тиофен → пиррол → фуран позволяет утверждать, что ароматичность, устойчивость циклической сопряженной системы к разрушению в этом ряду минимальны у фурана:
Ароматичность (термодинамическая устойчивость) гетероциклов неодинакова и выражена меньше, чем у бензола, так как влияние гетероатома в цикле делает распределение электронов неравномерным. С увеличением электроотрицательности гетероатома ароматичность гетероциклического соединения уменьшается. Например, уменьшение энергии резонанса в ряду бензол → пиридин → тиофен → пиррол → фуран позволяет утверждать, что ароматичность, устойчивость циклической сопряженной системы к разрушению в этом ряду минимальны у фурана:
| N | S | N O | |
| энергия резонанса 151 | 134 | 120 | H 100 92 |
| (кДЖ/моль) | (130) |
 |
уменьшение ароматичности
4. π-Избыточность и π-недостаточность ароматических гетероциклов.
Под π-избыточностью и π-недостаточностью понимают изменение электронной плотности на атомах углерода гетероцикла (в целом) по сравнению с бензолом в результате влияния гетероатома.
π-Избыточными являются пятичленные ароматические гетероциклические соединения с одним гетероатомом: на пять атомов цикла приходится шесть π-электронов (у бензола на шесть атомов цикла – шесть π-
электронов), и пиррольный гетероатом оказывает электронодонорное влияние в цикле.
π-Недостаточными являются шестичленные ароматические гетероциклические соединения, так как пиридиновый гетероатом в цикле оказывает электроноакцепторное действие.
 N
N

H
 ЭДN 6 p e >1 ЭАN
ЭДN 6 p e >1 ЭАN


(+МN>-IN) 5
(-МN, -IN)
π-ибыточный π-недостаточный гетероцикл гетероцикл
Второй гетероатом в цикле уменьшает π-избыточность пятичленных и увеличивает π-недостаточность шестичленных гетероциклов.
ЭА
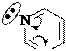



 ЭА
ЭА
 N N X X
N N X X
ЭА ЭА
ЭД ЭД
 |  |
p-недостаточностые p-избыточностые
увеличение электронной плотности в цикле
 N
N
 ЭА
ЭА

N ЭД H

 больше больше
больше больше
электронная электронная
плотность плотность
5. Ацидофобность ароматических гетероциклов.
Ацидофобность – «боязнь кислоты». Ацидофобные гетероциклические соединения в присутствии сильных кислот превращаются в смесь полимеров,
«осмоляются».
Ацидофобность характерна для низкоароматичных пятичленных ароматических гетероциклов, например, фурана и пиррола. Ароматическая система тиофена более устойчива, и тиофен, практически, неацидофобен.
Причиной «осмоления» ацидофобных гетероциклов является разрушение их ароматического строения в результате присоединения протона. Продукты присоединения протона к фурану и пирролу не имеют
 ароматического строения и являются активными сопряженными диенами, происходит их полимеризация с раскрытием цикла:
ароматического строения и являются активными сопряженными диенами, происходит их полимеризация с раскрытием цикла:

 H+
H+
 H H O
H H O
sp3
H H
H полимеризация


 O H
O H
 |
 нет ароматического строения
нет ароматического строения
Электроноакцепторные заместители (-NO2, -COOH, C=O и др.) уменьшают ацидофобность гетероцикла: уменьшается электронная плотность в цикле и уменьшается поэтому его способность присоединять протон.
Пятичленные ароматические гетероциклы с двумя и более гетероатомами неацидофобны, они имеют в молекуле основный центр на пиридиновом гетероатоме. В результате протонирования пиридинового гетероатома образуется достаточно устойчивый катион с ароматическим строением. По этой же причине и шестичленные гетероциклы неацидофобны.
основный

 центр H H
центр H H

 N
N
 |  | ||
 H+
H+
X X X
 |
H+ эти катионы имеют



 ароматическое
ароматическое
 N N строение H
N N строение H
6. Кислотно-основные свойства пятичленных гетероциклов.
Возможность кислотных и/или основных свойств у гетероциклических соединений обусловлена присутствием в их молекулах соответственно кислотных и/или основных реакционных центров.
Кислотные свойства.
Наиболее активные кислотные центры гетероциклов сформированы протонами, обычно, на пиррольных гетероатомах: делокализация электронной плотности пиррольного гетероатома в кольцо увеличивает подвижность протона за счет увеличения полярности связи протона с гетероатомом и увеличения устойчивости соответствующего аниона. Поэтому кислотные свойства гетероциклов увеличиваются при переходе от насыщенных соединений с sp3 – гибридными гетероатомами к ароматическим. Кислотные свойства гетероциклических соединений с двумя
гетероатомами (пиридиновый гетероатом - электроноакцептор) более выражены, чем у соединений с одним гетероатомом.
Например, среди пятичленных ароматических гетероциклических соединений N-H кислотные свойства характерны, для пиррола, пиразола, имидазола, индола и других подобных соединений. Кислотные свойства всех этих соединений существенно выше, чем у насыщенного пирролидина. Кислотные свойства имидазола, индола и бензимидазола более выражены, чем у пиррола.
Изменение N-H кислотных свойств (рКа в ДМСО):
 ЭА
ЭА
 sp3 N
sp3 N
H
<< < <

 sp2 N N N
sp2 N N N
H H H
пирролидин рКа 23 рКа~19 рКа 44
меньше
N
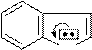
 H pKa~21
H pKa~21
 |
электронная плотность
увеличение кислотных свойств
Пиррол как N-H кислота образует соли в реакциях с калием К, твердым гидроксидом калия КОН (при температуре выше 100оС), NaNH2 в жидком аммиаке. Продуктом этих реакций является соль пирролкалий (или пирролнатрий).
Примеры реакций:
 K
K
-H2
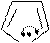 KOH тв., to
KOH тв., to
 N -HOH
N -HOH
H KNH2
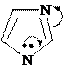 -NH3
-NH3
KOH тв., to

-HOH
H
пирролкалий
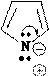 K
K
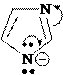 имидазолкалий
имидазолкалий
K 
Отрицательный заряд в анионе делокализован. Например, в пиррол- анионе:
 |  | ||
N N N
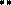

 Кислотные свойства пиррола (N – H кислота) выражены слабо (слабее, чем у одноатомных спиртов – О-Н кислоты), поэтому соли пиррола в воде полностью гидролизованы:
Кислотные свойства пиррола (N – H кислота) выражены слабо (слабее, чем у одноатомных спиртов – О-Н кислоты), поэтому соли пиррола в воде полностью гидролизованы:
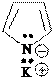 + HOH
+ HOH
+ KOH

 N
N
H
сильное основание в растворе
Основные свойства.
Основный центр в молекулах гетероциклических соединений сформирован на гетероатомах, имеющих подходящую неподеленную пару электронов; в молекулах ароматических гетероциклов основные свойства имеет пиридиновый гетероатом. Поэтому основные свойства не характерны для пятичленных ароматических гетероциклических соединений с одним гетероатомом (он пиррольный), в кислой среде эти соединения не образуют солей (устойчивых катионов), а N- и О- содержащие пятичленные ароматические гетероциклы показывают ацидофобность.
Основные свойства характерны для пятичленных ароматических гетероциклов с двумя гетероатомами (второй гетероатом пиридиновый). Пиррольный гетероатом действует при этом как электронодонор, способствуя проявлению соединением основных свойств. Пятичленные ароматические гетероциклические соединения в целом являются довольно слабыми основаниями. Их основные свойства выражены существенно слабее, чем у насыщенных гетероциклических соединений. Основные свойства насыщенных гетероциклов максимально выражены у азотсодержащих соединений. Это сильные основания, их основные свойства соответствуют основности алифатических аминов. Кислород- и серусодержащие насыщенные гетероциклы имеют более слабые (особенно, содержащие серу) основные свойства, аналогичные свойствам простых эфиров и сульфидов.
Изменение основных свойств:
 NH(C2H5)2~
NH(C2H5)2~
sp2
 N
N
>>
основный центр
 >
>
основный центр
sp3
N основный
 H центр
H центр
N ЭД
 H
H
O более слабый ЭД
|
| пирролидин | имидазол | оксазол | |
| рКВН | 11 | 11.3 | 7 | |

Примеры реакций:
увеличение основных свойств


 HCl
HCl


 N N
N N
H H H
Cl-
пирролидиний хлорид



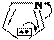

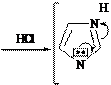

 N Cl-
N Cl-
H H
имидазолий хлорид
|
H
 H2SO4 N
H2SO4 N


 N N
N N
H H
HSO -
7. Таутомерия пятичленных ароматических гетероциклов.
Таутомерия пятичленных ароматических гетероциклических соединений является прототропной таутомерией и осуществляется обратимым переносом протона внутри молекулы из ее кислотного центра в основный. Перенос протона сопровождается перераспределением электронной плотности.
Для осуществления таутомерных превращений необходимо присутствие в молекуле достаточно активных как кислотного, так и основного центров. Поэтому среди незамещенных пятичленных ароматических гетероциклов прототропная таутомерия возможна для азотсодержащих циклов с двумя и более гетероатомами, например, для имидазола. Скорость переноса протона чрезвычайно велика и разделить таутомеры невозможно.
Схема прототропной таутомерии имидазола.
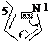
 основный кислотный
основный кислотный
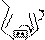
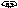 R 4 3
R 4 3
N
RH
 5 2 4 2
5 2 4 2
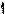
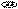 N 1 N 3
N 1 N 3
H
кислотный основный
4-алкилимидазол 5-алкилимидазол
Важным производным имидазола является α-аминокислота гистидин. Из-за прототропной таутомерии гистидин может быть представлен как 2- амино-3-[4(5)-имидазолил]- пропановая кислота.
Таутомерия гистидина:

 H3N
H3N
CH COO-

 H3N
H3N
CH COO-



 CH2
CH2
 4 N 3
4 N 3
CH2 H
 5 N 1
5 N 1

 5 2 4 2
5 2 4 2
 N 1 N 3
N 1 N 3
H
 |
В переносе протона в процессах таутомерии имеет значение межмолекулярная ассоциация, которая осуществляется образованием водородных связей между кислотным центром одних молекул и основным других:
N N H N N H N N H
8. 









 Реакции электрофильного замещения у пятичленных ароматических гетероциклов.
Реакции электрофильного замещения у пятичленных ароматических гетероциклов.
Реакции электрофильного замещения у пятичленных ароматических гетероциклов в общем аналогичны этому типу реакций у аренов. Они осуществляются по механизму SE через последовательное образование π- и σ- комплексов, а затем – продукта. У гетероциклов с одним гетероатомом электрофильное замещение происходит преимущественно в α-положение к гетероатому, поскольку α-замещению соответствует более устойчивый σ- комплекс. Однако замещение возможно и в β-положение, особенно, если α- положения уже заняты.
В молекулах имидазола электрофильное замещение происходит в положения 5(4), у пиразола – в положение 4, т.е. в положения, наиболее удаленные от пиридинового гетероатома.
Схемы электрофильного замещения в общем виде:
 H H b E
H H b E
E
H H a
-H+
E +
 X X
X X
образуется
преимущественно
 4 3
4 3

 N 1 H
N 1 H
 5H
5H
 N 1
N 1
4 2
E+

 -H+ E
-H+ E

H
N
3
 43
43
N 2

 N 1 E
N 1 E
H E+
 4
4
 3 N H
3 N H
N 2 1
-H+ N

 N
N
H
Механизм SE:
 HH
HH
HH



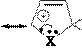


 E E+ a E E E
E E+ a E E E
H X H
H X H
замещение H
H X H
 p-комплекс
p-комплекс
b-замещение
a-s-комплекс более устойчив
 E
E
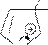
 E E преимущественный продукт реакции
E E преимущественный продукт реакции
 H H
H H
 |
X X
a-s-комплекс менее устойчив
 H
H
 X
X
Реакции электрофильного замещения у пятичленных ароматических гетероциклических соединений с одним гетероатомом (π-избыточные соединения) протекают с более высокой скоростью и более глубоко, чем у бензола. Но для проведения реакций нитрования, сульфирования и галогенирования ацидофобных гетероциклов необходимы, обычно, условия, исключающие присутствие сильной кислоты. Поэтому в качестве реагентов в реакциях, например, с фураном и пирролом используют: для нитрования -
 O
O
CH3-C
O-NO2 ацетилнитрат; для сульфирования – С5Н5N·SO3
пиридинсульфотриоксид; галогенирование проводят в присутствии пиридина или диоксана для связывания выделяющегося галогеноводорода.
Примеры реакций электрофильного замещения у ацидофобных гетероциклов:
реагент
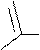
 O
O
CH3-C
O-NO2
-CH3COOH
NO2

 N
N
нитрование
субстрат
H 2-нитропиррол

 C5H5N SO3 -
C5H5N SO3 -
H SO3
сульфирование
 N -C5H5NH N
N -C5H5NH N
H H
анион
пиррол-2-сульфо -
кислота
 Br2, C6H5N
Br2, C6H5N
Br
 -[C5H5NH] Br N H
-[C5H5NH] Br N H
галогенирование


 Br Br
Br Br
 Br N Br H
Br N Br H
2,3,4,5-тетрабромпиррол
 +d O
+d O
 CH3-C
CH3-C
 O
O
, SnCl4


 H3C C O
H3C C O

 O
O
-CH3COOH C-CH3
O O
2-ацетилфуран
ацилирование
 Тиофен неацидофобен, поэтому в реакциях электрофильного замещения, обычно, не требует особых реагентов. Например, тиофен сульфируется концентрированной серной кислотой при комнатной температуре:
Тиофен неацидофобен, поэтому в реакциях электрофильного замещения, обычно, не требует особых реагентов. Например, тиофен сульфируется концентрированной серной кислотой при комнатной температуре:
 H2SO4 конц. SO3H
H2SO4 конц. SO3H
S S
тиофен-2-сульфокислота
Имидазол и пиразол – гетероциклические соединения с двумя гетероатомами – также неацидофобны. Их нитрование и сульфирование осуществляется обычными нитрующими и сульфирующими реагентами. Но для реакций необходимы условия более жесткие, чем у бензола, потому что
замещению предшествует образование катиона (положительно заряженный азот является сильным электроноакцептором).
Примеры реакций:
 H2SO4
H2SO4
|
-HSO -
 N
N
H
H

 N
N
 H2SO4 конц.
H2SO4 конц.
N to
 H -H2O
H -H2O
H

 N
N
HO3S

 N H
N H
Br 2, NaOH
 N -NaBr,
N -NaBr,
H -H2O
Br
 |
N

 N H
N H
Ацилирование и алкилирование имидазола и пиразола происходят преимущественно по пиридиновому атому азота и осуществляются обычными ацилирующими и алкилирующими субстратами. В этих реакциях имидазол и пиразол являются нуклеофильными реагентами (реакции SN).
Примеры реакций:
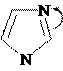 +d
+d
 CH3 I
CH3 I
 |
-I-
H
CH3
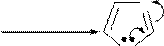
 N
N
 N -H+
N -H+
H
CH3

 N
N
N
 +d O
+d O
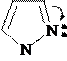

 CH3-C O O
CH3-C O O
Cl
 |
-Cl-
H
C-CH3

 N H
N H
-H+

 N C-CH3
N C-CH3
N
Реакции электрофильного замещения низкоароматичных пятичленных ароматических гетероциклов, таких как фуран, конкурируют с реакциями электрофильного присоединения АЕ, в ходе которых гетероцикл ведет себя как сопряженный диен. Часто продукты замещения образуются через стадию присоединения с последующим элиминированием. Например, в реакции галогенирования фурана возможны продукты как присоединения, так и замещения:

 HH
HH
Br Br 2
 Br Br
Br Br

 H O H
H O H
HH H H
 Br 2
Br 2
H H
 Br Br
Br Br
 H H
H H
Br O Br
Br O
Br
 -2HBr
-2HBr
 Br Br
Br Br
O
9. Таутомерия пиразолонов. Некоторые «лекарственные» производные пиразолона-3.
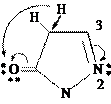
Структурной основой пиразолонов является σ-скелет пиразола (диазол- 1,2). Пиразолоны – участники таутомерного равновесия, которое в общем случае может быть представлено состоящим из трех таутомеров: 1Н, 2Н- пиразол-он-3 (пиразолон-3); 1Н, 4Н-пиразол-он-5 (пиразолон-5); 5-гидрокси- 1Н-пиразол. Пиразолон-5 и пиразолон-3 связывает прототропная таутомерия, пиразолон-5 и третий таутомер – кето-енольная таутомерия.
Схема таутомерии пиразолонов:
 45
45
 O N H
O N H
 HO
HO
43
 N 2
N 2
|
3 N 1 N

 1
1
 H 1 H
H 1 H
H
пиразолон-3 пиразолон
Считается, что введением в структуру молекулы дополнительных заместителей равновесие может быть смещено в сторону того или иного таутомера.
Тем не менее можно предположить, что наиболее устойчивым из трех таутомеров является пиразолон-3, так как пиразолон-5 не имеет ароматического строения, а третий таутомер-наиболее сильная ОН-кислота.
Вследствие таутомерии для пиразолонов характерны как реакции электрофильного замещения (SE) в 4-е положение пиразолона-3, так и алкилирование (SN) по атому азота (N-2 в пиразолоне-5 или 5- гидроксипиразоле).
Схемы реакций пиразолонов:
 H O=N
H O=N
 O N H
O N H
 N H
N H
HO-N=O
O N H


 N H
N H
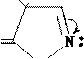 H H
H H
+d
 CH3 I
CH3 I
 O -I-
O -I-

 N
N
H
H H
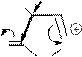
 O N CH3 N
O N CH3 N

H
H

 -H+ O
-H+ O
 N CH3
N CH3
 N
N
H
Производные пиразолонов применяются как лекарственные средства. Наиболее известны антипирин, анальгин, бутадион. Реакцией ацетоуксусного эфира с фенилгидразином может быть получен 3-метил-1-фенилпиразолон-5, при метилировании которого образуется антипирин (1,5-диметил-2- фенилпиразолон-3).
Схема синтеза антипирина.
 O +d
O +d
AN-E
H5C2O
 O
O
C CH2-C-CH3
 O
O
+ NH2-NH-C6H5
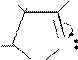 H
H

-H2O
H CH3
 +d
+d
4CH3
|
SN
 |
+d
SN
CH3 I
 C CH2-C-CH3
C CH2-C-CH3
-HOC H O
N -HI O 3
N CH3



 H5C2O N 2 5 N
H5C2O N 2 5 N
N 2 1
 HN
HN
C6H5
C6H5
C6H5
антипирин
Нитрозированием антипирина, восстановлением нитрозо- до аминогруппы и алкилированием аминогруппы получали 1,5-диметил-4- диметиламино-2-фенилпиразолон-3.
Схема синтеза 1,5-диметил-4-диметиламино-2-фенилпиразолона-3:
 HCH3 SE
HCH3 SE
O=N CH3
 HO-NO
HO-NO
4[H]
 O N CH3
O N CH3
 N
N
-HOH
O


 N C6H5
N C6H5
N CH3

-H2O
 C6H5
C6H5
 H2NCH3
H2NCH3
H3C
 H C
H C
NCH3
 SN 3
SN 3

 O
O
 N C6H5
N C6H5
N CH3
2CH3-I
 O
O
-2HI


 N C6H5
N C6H5
N CH3
Анальгин получают, если на стадии алкилирования аминогруппы используют бисульфитное производное формальдегида и метилиодид.
Схема синтеза анальгина.
 H2N CH3
H2N CH3
NaO3S-H2C

 +d
+d
CH3

 N
N
CH3

 O N CH
O N CH
1) HO CH2 SO3Na
 O
O
-H O
N CH3
3 2



|
N +d
C6H5
2) CH3 I
-HI
C6H5
анальгин
10. Восстановление и окисление пятичленных ароматических гетероциклов.
Пятичленные ароматические гетероциклические соединения с одним гетероатомом способны восстанавливаться (гидрироваться) как водородом на твердом катализаторе, так и водородом в момент его выделения. В случае пиррола и тиофена могут получаться продукты неполного восстановления – непредельные гетероциклы, которые можно рассматривать как результат 1,4- и 1,2-присоединения.
 Примеры реакций:
Примеры реакций:
 N H
N H
Zn, CH3COOH 

 N
N
H
H2, Ni


 to, p N
to, p N
H
пирролин-3 пирролидин
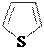
 Na, C2H5OH
Na, C2H5OH
 +
+
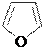 H2, Ni
H2, Ni
P, to
H2,катализатор
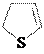

 to
to
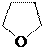 |
тетрагидрофуран
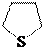
тиофан

 H2, Cu
H2, Cu
 |
to, P
H
N H
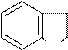
 индолин
индолин
H2, Pt
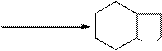 P, to
P, to
 N
N
H

 Восстановление в более жестких условиях часто сопровождается размыканием гетероцикла:
Восстановление в более жестких условиях часто сопровождается размыканием гетероцикла:
 H2, Ni
H2, Ni
 |
P, to
H
CH2-CH3 NH2
 Li, CH3NH2
Li, CH3NH2
в метаноле
HO-CH
2-CH2-CH2-CH3
Пиразол (диазол-1,2) также способен восстанавливаться до пиразолина-2 и пиразолидина:

 N Na,C2H5OH
N Na,C2H5OH
 N H
N H
H2, Pd



 N N to, P N NH
N N to, P N NH
H H
пиразолин-2 пиразолидин
Имидазол (диазол-1,3) не восстанавливается.
Окислению достаточно легко подвергаются пятичленные ароматические гетероциклы с одним гетероатомом. В зависимости от условий окисления образуются разные продукты. В наиболее мягких условиях окисляются углеводородные заместители на гетероцикле с образованием карбоновых кислот.
 CH2-CH3 6 [o]
CH2-CH3 6 [o]
S -CO2
-2H2O
COOH
 S
S
тиофен-2-карбоновая кислота
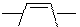 По циклу окисляется легче других фуран. В растворе его можно окислить до малеинового ангидрида:
По циклу окисляется легче других фуран. В растворе его можно окислить до малеинового ангидрида:
 H2O2, to
H2O2, to


| |||||||||||||||||
O O
концентрированная кислота окисляет тиофен с расщеплением гетероцикла.
Имидазол и пиразол более устойчивы к окислению гетероцикла. Имидазол выдерживает действие хромовой кислоты. Бензимидазол в большинстве случаев окисляется по бензольному кольцу:
 N KMnO 4
N KMnO 4
HOOC

 N
N
 N HOOC N
N HOOC N
 H
H
H
имидазол-4,5-дикарбоновая кислота
Однако в более жестких условиях цикл имидазола разрушается:
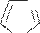 N [o]
N [o]
 N H
N H
O

 C
C
 NH2
NH2
 C NH2 O
C NH2 O
11. Взаимные превращения пятичленных ароматических гетероциклов (реакция Ю.К.Юрьева).
При высокой температуре (~ 350оС) на катализаторе (Al2O3)
пятичленные ароматические гетероциклы способны к взаимным превращениям под действием подходящего реагента:

 H2O
H2O

 N Al2O3, to
N Al2O3, to
H NH3
H2S
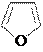

 Al2O3, to H2O
Al2O3, to H2O
NH3 

 Al2O3, to N
Al2O3, to N

H2S H
12. Примеры лекарственных средств и биологически значимых соединений на основе пятичленных гетероциклов.
 O
O
 ON2 C=N-NH-C-NH2 H
ON2 C=N-NH-C-NH2 H
Фурацилин (семикарбазон 5-нитрофуран-2-карбальдегида);
антибактериальное средство.
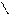 NaO3S-CH2
NaO3S-CH2
 N
N
H3C
CH3
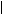
 O N N
O N N
CH3
C6H5
Анальгин (Na-соль N-метил-N-сульфометил-4-амино-2,3-диметил-1- фенилпиразолон-5); жаропонижающее, болеутоляющее средство.
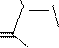
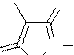 CH3CH2CH2CH2
CH3CH2CH2CH2
O
O
N C6H5
 N
N
C6H5
Бутадион (1,2-дифенил-4-бутилпиразолидиндион-3,5); болеутоляющее, противовоспалительное средство.
 O
O

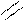 N
N
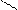 CH2-C
CH2-C
O NH2
Пирацетам (2-[2-оксо-1-пирролидинил] этанамид). Восстанавливает и стабилизирует нарушенные функции мозга, нормализует его обменные процессы и кровообращение.
 CH2-COOH
CH2-COOH
 N H
N H
 |  | ||
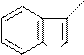
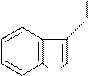 Гетероауксин (β-индолилуксусная кислота), гормон роста у растений.
Гетероауксин (β-индолилуксусная кислота), гормон роста у растений.
NH3-CH-COO CH2
 N H
N H
Триптофан (2-амино-3-[3-индолил] пропановая кислота); незаменимая α-
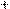 |  | ||

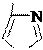 аминокислота.
аминокислота.
NH3-CH-COO CH2
 N H
N H
Гистидин (L-2-амино-3-[4(5)-имидазолил] пропановая кислота);
незаменимая α-аминокислота; применяется при лечении гепатита, язвенной болезни; в организме декарбоксилируется в гистамин.
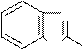
 N
N
 N CH2 H
N CH2 H
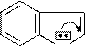
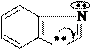
Дибазол (2-бензилбензимидазол); применяется в виде соли соляной
кислоты (2-бензилбензимидазола гидрохлорид) для лечения гипертонической болезни.
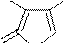 C2H5
C2H5
O O
CH2
 N
N
CH3
Пилокарпин; применяется в виде соли-пилокарпина гидрохлорид; алкалоид, широко используется в офтальмалогии.
 O
O
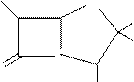 R-C-HN
R-C-HN
O
S
CH3
N CH3
COOH
Общая формула пенициллиновых антибиотиков (производные пенициллановой кислоты, частью структурной основы которой является гетероцикл тиазолидин).








