Основные свойства и классификация металлов
Металлы в твердом и отчасти в жидком состоянии обладают рядом характерных свойств:
— высокой тепло- и электропроводностью;
— положительным температурным коэффициентом электросопротивления: с повышением температуры электросопротивление чистых металлов возрастает; большое число металлов обладает сверхпроводимостью, у этих металлов при температуре, близкой к абсолютному нулю, электросопротивление падает скачкообразно практически до нуля;
— термоэлектронной эмиссией, т.е. способностью испускать электроны при нагреве;
— хорошей отражательной способностью; металлы непрозрачны и обладают металлическим блеском;
— повышенной способностью к пластической деформации.
Наличие этих свойств и характеризует так называемое металлическое состояние вещества.
Все металлы и металлические сплавы — тела кристаллические. В узлах кристаллических решеток металлов находятся положительно заряженные ионы, а между ними свободно перемещаются электроны (электронный газ). Характерные свойства металлов объясняются специфическими свойствами металлической связи.
Металлы делятся на две группы:
— черные: железо, марганец, хром;
— цветные — все остальные.
Цветные металлы по разным признакам делятся на подгруппы:
— тяжелые, имеющие плотность больше 5 г/см3 (цинк, медь, олово, свинец, серебро, золото и др.);
— легкие, имеющие плотность до 5 г/см3 (литий, натрий, магний, калий, алюминий и др.);
— тугоплавкие, температура плавления которых выше, чем у железа (ниобий, молибден, вольфрам и др.);
— легкоплавкие (цезий, галий, калий, натрий, олово, свинец и др.);
— редкие (молибден, вольфрам, ванадий и др.);
— благородные (золото, серебро, платина, палладий и др.); и другие.
Атомно-кристаллическое строение металлов
Под атомно-кристаллической структурой понимают взаимное расположение атомов, существующее в кристалле. Кристалл состоит из атомов (ионов), расположенных в определенном порядке, который периодически повторяется в трех измерениях.
В кристаллах существует не только ближний, но и дальний порядок размещения атомов, т.е. упорядоченное расположение частиц в кристалле сохраняется на больших участках кристаллов.
Для описания атомно-кристаллической структуры пользуются понятием пространственной или кристаллической решетки.
Кристаллическая решетка представляет собой воображаемую пространственную сетку, в узлах которой располагаются атомы (ионы), образующие металл (твердое кристаллическое тело).
Наименьший объем кристалла, дающий представление об атомной структуре металла во всем объеме, получил название элементарной кристаллической ячейки.
Подавляющее число технически важных металлов образуют одну из следующих решеток: кубическую объемно-центрированную, куби-ческую гранецентрированную и гексагональную (рис. 9).
В кубической объемно-центрированной решетке атомы расположены в узлах ячейки и один атом — в центре объема куба (рис. 9, а). Кубическую объемно-центрированную решетку имеют металлы: а-железо, хром, ниобий, вольфрам, ванадий и др.
В кубической гранецентрированной решетке атомы расположены в углах куба и в центре каждой грани (рис. 9, б). Этот тип решетки имеют металлу: у-железо, никель, медь, золото и др.
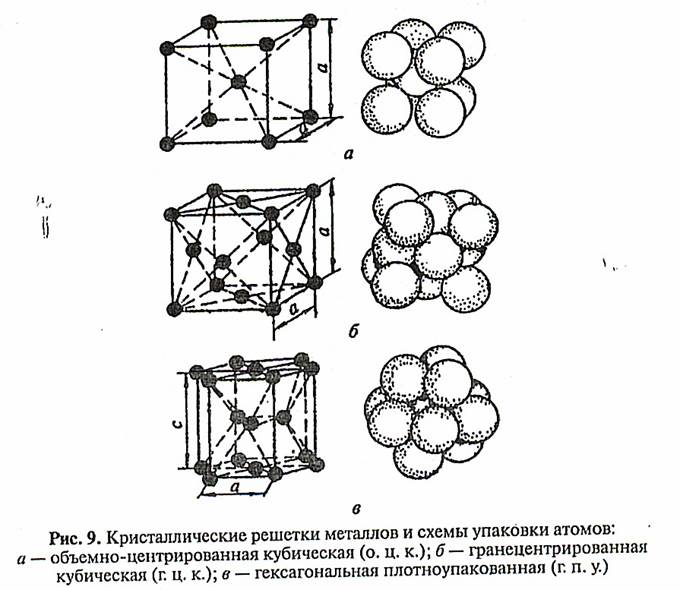
В гексагональной решетке (рис. 9, в) атомы расположены в углах и центре шестигранных оснований призмы и три атома в средней пло-скости призмы. Эту упаковку атомов имеют следующие металлы: магнии, цинк и др.
Некоторые металлы имеют тетрагональную решетку.
Размеры кристаллической решетки характеризуются величинами периодов, под которыми понимают расстояние между ближайшими параллельными атомными плоскостями, образующими элементарную ячейку (рис. 9). Период решетки измеряется в ангстремах (А).
Период решетки металлов находится в пределах от 1 до 7 А.








