Стандартизация материалов
Стандартизация материалов — это установление и применение правил производства и переработки материалов для достижения их оптимального использования и соблюдения требований безопасности.
Главными целями стандартизации материалов являются повышение эффективности производства, улучшение качества промышленной продукции, установление оптимальной номенклатуры материалов, а также нормальных экологических условий, охраны здоровья населения и безопасности труда работающих. Для достижения этих целей предусматривается установление:
— контрольных характеристик сырья, материалов и полуфабрикатов, обеспечивающих изготовление изделий с высокими показателями качества;
— единой системы показателей качества, методов и средств контроля и испытаний, а также необходимого уровня надежности мате-риалов в зависимости от назначения и условий эксплуатации;
— норм и требований в области производства материалов с целью исключения неэффективных видов, марок и типоразмеров;
— систем классификации материалов и кодирования технико- экономической информации об их свойствах;
— правил по безопасности труда при изготовлении и переработке материалов;
§ 154. Общая характеристика элементов. ГК элементам VIII группы семейства железа относятся железо, кобальт и никель.
Рассматриваемые элементы образуют химические связи за счет орбиталей внешнего и предвнешнего электронных слоев .У атома железа валентные, электроны заполняют орбитали следующим образом;
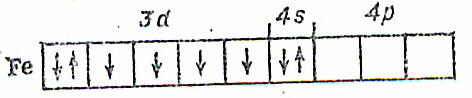
При возбуждении атома железа один из спаренных 4s-электронов переходит из 4s- в 4р-состояние. В результате этого у атома железа оказывается шесть неспаренных электронов. В этом состоянии железо может проявлять валентность, равную шести.
Наиболее характерны степени окисления +2 и +3, известны также производные железа, в которых его степень окисления равна —2, О, +4 и +6
Для элементов подгруппы железа характерны координационные числа 4 и 6
§ 155. Железо и его соединения. Химически чистое железо —серебристо-белый пластичный металл. Легко намагничивается и размагничивается. Плотность — 7870 кг/м3. При 1539°С железо плавится, а при 2740°С кипит. Оно обладает хорошей ковкостью, электрической проводимостью и теплопроводностью.
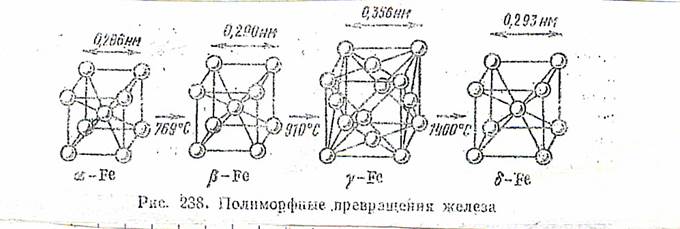
Железо имеет несколько модификаций (рис. 238). До 769°С устойчиво а-железо с обьемно центрированной кубической решеткой и ферромагнитными свойствами. При 709 °С a-Fe переходит в p-Fe; исчезают ферромагнитные свойства и железо становится парамагнитным, но кристаллическая структура его существенно не изменяется. При 910 °С происходит полиморфное превращение, втором изменяется структура — образуется гранецентрированная кристаллическая решетка по металл остается парамагнитным. При 1400°С происходит новый полиморфный переход и образуется 5-Fе с объемно центрированной кубической решеткой, существующее вплоть до температуры плавления железа (1539°С)
Железо высокой чистоты устойчиво на воздухе и в воде вследствие образования на поверхности сплошной пленки оксидов. Однако обычное железо, содержащее, различные примеси, но влажной атмосфере быстро покрывается ржавчиной: 4Fe + 3О2 6Н2О — 4Fe (ОН)3.
В порошкообразном состоянии железо легко окисляется кислородом воздуха, давая при этом оксид железа (III) или Fe3О4: 4Fe + 3О2 = 2Fe2О3; 3Fe + 2О2 = Fe3О4. Оно легко взаимодействует с хлором, образуя хлориды FeCl2 и FeCI3. При нагревании железо вступает в реакцию со многими веществами — углеродом, азотом, серой и другими неметаллами:
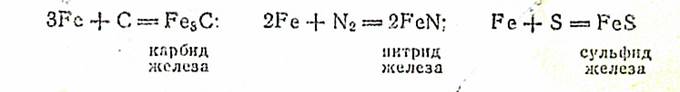
Железо легко растворяется в разбавленной соляной в серной кислотах
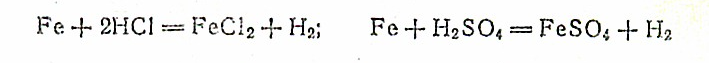
в концентрированной серной кислоте — только при нагревании:
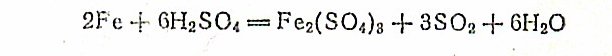
В концентрированной азотной кислоте железо пассивируется, так как покрывается плотной пленкой нерастворимых оксидов.
Железо образует два ряда соединений со степенями окисления +2 и +3. Более устойчивы соединения железа(Ш). 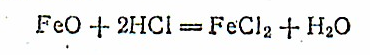
Соединения железа(II)'. Оксид железа(II) FeO — основной оксид, представляющий собой кристаллы черного цвета, не растворяется в воде, но легко растворяется в кислотах:
FeO можно получить из Fe2О3 действием оксида углерода (II) при 500С: Fe2О3+СО = 2FeO+СО2. Соли Fe(II) являются восстановителями:
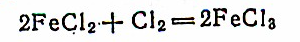
На воздухе в присутствии воды они постепенно окисляются в соли Fe (III):
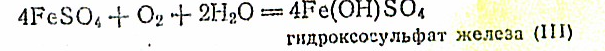
Если к раствору соли железа (II) прибавить раствор щелочи, то выпадает гидроксид железа{11) голубовато- белого цвета:
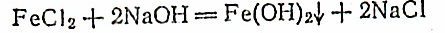
Осадок быстро темнеет, становится черным, а затем бурым. Следовательно, Fe(OH)2 также является восстановителем: 4Fe(OH)2 + О2 +Н2О= 4Fe(OH)3.
Соединения железа'(Ш). Оксид железа.(Ш)— твердое порошкообразное вещество красно-бурого цвета. Он обладает слабо выраженными амфотерными свойствами— при сплавлении со щелочами или карбонатами щелочных металлов образует ферриты.
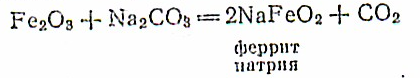
Ферриты, будучи образованы очень слабой кислотой (HFeO2), полностью гидролизуются водой:
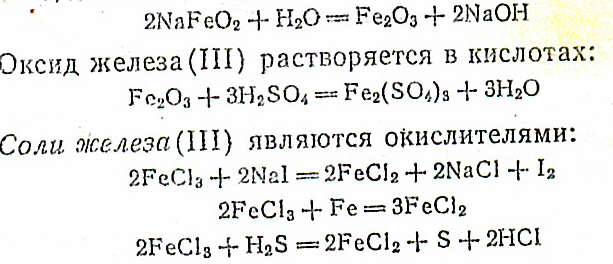
Под действием воды они в значительной степени гидролизуются, образуя основные соли:
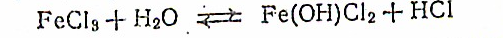
Такие растворы окрашены в темно-коричневый цвет. При подкислении гидролиз подавляется, равновесие смещается влево и окраска раствора ослабевает.
Кроме солей Fe(II)' и Fe(III) известны ферраты — соли железной кислоты H2FeО4, не существующей в свободном состоянии. Ферраты получают окислением железа или оксида железа(Ш). сильными окислителями:
Fe2О8 + 3KNО8 + 4КОН = 2IC2FeО4 + 3ICNО2 + 2Н2О
В растворах феррат калия K2Fe04 (темно-красного цвета) постепенно разлагается с выделением кислорода:
4K2FeО4 + 10Н2О = 4Fe(OH)3 + 8КOH + 3О2
В кислой среде ферраты проявляют сильные окислительные свойства:
2K2FeО4 + 16НС1= 4КCl + 2FeCl3 + ЗСl2 + 8Н2О
Комплексные соединения железа. Железо проявляет заметную склонность к реакциям комплексообразования. Из устойчивых комплексных соединений железа заслуживают внимания желтая и красная кровяные соли.
Желтая кровяная соль образуется при действии на раствор соли железа (II) избытка цианида калия:
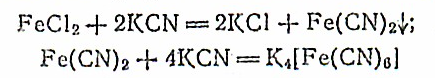
Калий гексацианоферрат(II) K4[Fe(CN)6)—соль железистосинеродистой кислоты H4[Fe(CN)6]. Красная кровяная соль, или калий гексацианоферрат(III) K3[Fe(CN)6], — соль железосинеродистой кислоты Н3[Fe(CN)6].
Важным свойством желтой кровяной соли является взаимодействие ее с ионами Fe3+ в растворах, приводящее к образованию синей труднорастворимой соли KFe[Fe(CN)6], называемой берлинской лазурью:
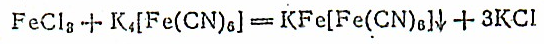
Красная кровяная соль взаимодействует с ионами Fe2+ в растворах, образуя малорастворимую в воде соль ярко-синего цвета KFe[Fe(CN)6]—турнбуллеву синь
FeCl2 + K8[Fe(CN)6] = KFe[Fe(CN)6]2 + 2КС1
Считают, что берлинская лазурь и турнбуллева синь идентичны, так как в растворе наблюдается окислительно-восстановительное равновесие:
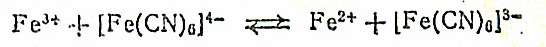
§ 156. Кобальт и его соединения. Кобальт— твердый, серебристо-белый, ковкий, внешне похожий на железо металл. Плотность — 8830 кг/м3. Плавится при 1439 °С, кипит при 2255 °С.
Кобальт более устойчив к действию воды, воздуха и кислот, чем железо. Обладает магнитными свойствами. В компактном виде заметно не реагирует даже с типичными неметаллами — кислородом, серой и галогенами, но проявляет значительную химическую активность в измельченном состоянии при нагревании. С азотом кобальт непосредственно не соединяется. С серой, хлором и бромом кобальт взаимодействует только в присутствии влаги и при нагревании, образуя соответственно сульфид CoS, хлорид СоСl2 и бромид СоВr2. При сильном нагревании он реагирует с фосфором и углеродом с образованием фосфида и карбида. Однако карбид кобальта Co3C неустойчив и при охлаждении разлагается.
Кобальт устойчив по отношению к воде, медленно растворяется в разбавленных растворах соляной, серной и азотной кислот:
Со + 2НСl = CoCI2 + Н2; Со + H2SO4 = CoSO4 + Н2
ЗСо + 8HNO3 = 3CO(NO3)2 + 2NO + 4Н2O
Кобальт, как и железо, пассивируется на холоду при соприкосновении с концентрированной азотной кислотой.
Подобно железу кобальт образует соединения со степенями окисления +2 и +3. Оксид и гидроксид кобальта(II) сходны с соответствующими соединениями железа. Это проявляется не только в их основном характере, но и в способности медленно окисляться на воздухе:
4Co(OH)2 + О2 + 2Н2O = 4Со(ОН)3
Оксид и гидроксид кобальта(III), в отличие от оксида и гидроксида железа(III), не обнаруживают амфотерных свойств и являются окислителями:
2Со2O3 + 4H2SO4 = 4CoSO4 + 4Н2O + O2
2Со(ОН)з + 6HCI = 2СoСl2 + Сl2 + 6Н2O
Кобальт обладает ярко выраженной склонностью к образованию комплексных соединений. Для большинства из них характерно координационное число 6. Известно много самых разнообразных соединений кобальта (III), в состав которые входит кобальт в качестве комплексного катиона или комплексного аннона. Примером таких соединений могут служить [Со(NН3)6]Cl3 и K3[Co(NO2)6].
Кобальт имеет большое значение в производстве легированных сталей, в частности быстрорежущих магнитных и жароупорных сталей. Многие кислотоупорные сплавы содержат значительные количества кобальта. Так, сплав состава [в % (масс.)]: 75 Со, 13 Si, 7 Сг и 5 Мn, по кислотостойкойсти превосходит даже платину. Кобальт является составной частью многих катализаторов. На основе кобальтовых соединений изготавливают краски и эмали разного цвета. Радиоактивный изотоп кобальт-60 используют в медицине для борьбы с раковыми заболеваниями («кобальтовая пушка»).
Железо — один из наиболее распространенных элементов в природе; содержание его в земной коре составляет 5% (масс.). Кобальта н никеля в земной коре намного меньше: 2,3*10-3% (масс.) Со и 8*10-3% (масс.) Ni.
Важное значение имеют следующие минералы железа: магнетит (магнитный железняк) Fe3O4 гематит (красный железняк) Fe2О3, лимонит (бурый железняк) Fe2O3+H2O, сидерит (железный шпат) FeCО3. В природе встречаются также мышьяковистые и сернистые соединения железа: пирит (железный колчедан) FeS2, арсенопирит (мышьяковый колчедан) FeAsS.
Важнейшими минералами, содержащими кобальт и никель, являются: кобальтин (кобальтовый блеск) CoAsS, никелин (красный никелевый колчедан) NiAs, герсдорфит (никелево-мышьяковый блеск) NiAsS.
Крупные месторождения железных руд 1 расположены на Урале, в Кривом Роге, на керченском полуострове, в области Курской магнитной аномалии, в Западной и Восточной Сибири, а также на Дальнем Востоке.
Чистое железо получают электролизом растворов FeSO4 или FeCl3, а также восстановлением оксидов железа в токе водорода при нагревании: Fе2О3 + ЗН2 = 2Fc + ЗН2О. Кобальт и никель получают в свободном виде при восстановлении их оксидов углем, водородом или алюминием, а также электролизом их солей.
В промышленности железо выплавляют из руд путем его восстановления коксом при высоких температурах. При этом получают чугун, содержащий 93—95% (масс.) Fе, 2—4% (масс.) С и примеси кремния, марганца, серы и фосфора. Чугун, по существу, является сплавом железа с перечисленными элементами. Температура плавления чугуна (от 1050 до 1135°С) значительно ниже, чем чистого железа (1539 °С). Выплавку чугуна производят в специальных вертикальных печах — домнах, диаметром 6—8 и высотой 25—31 м и более (рис. 77). Кожух доменных печей изготавливают из стали, а футеровку — из огнеупорного кирпича.
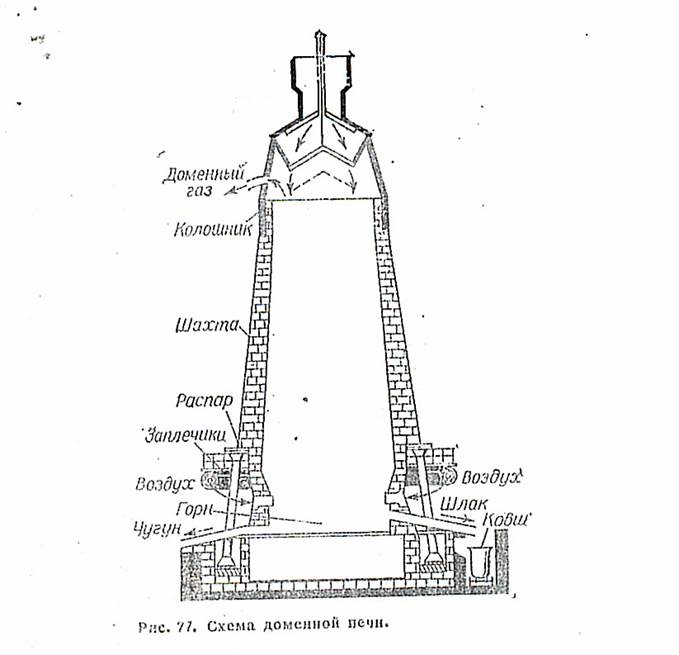
Доменную печь загружают сверху сначала коксом, а затем послойно смесью руды с коксом и флюсом (СаСО3 или SiO3) и окончательно одним коксом. Снизу и горн вдувают горячий воздух или кислород. На разных уровнях печи протекают различные химические процессы, В нижней зоне (в горне) в условиях высокой концентрации кислорода образуется оксид углерода (IV). Проходя через раскаленные слои кокса, он восстанавливается до оксида углерода (II):
СО2 + С = 2СО
По мере перемещения железной руды (например, Ре20з) внутри печи происходит постепенное восстановление оксидов железа до металлического железа;
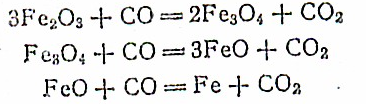
Одновременно восстанавливаются оксиды других элементов, содержащихся в железной руде.
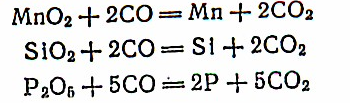
Восстановленное железо, а также марганец и кремний в расплавленном виде в горячей зоне печи при 800— !400°С частично взаимодействуют с СО, образуя карбиды:
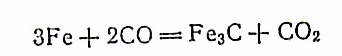
В верхней зоне доменной печи происходит разложение отдельных соединений, содержавшихся в железной руде в незначительных количествах:
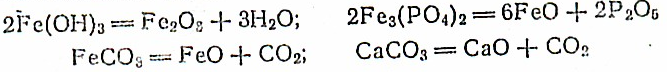
Железные руды, загружаемые в доменную печь, содержат пустую породу (SiО2, CaCО3, MgCО3). При выплавке чугуна возникает необходимость превратить эти примеси в легкоплавкие соединения меньшей плотности, чем плотность чугуна. Для этой цели, наряду с рудой и коксом, в доменную печь загружают флюсы — СаСО3, MgCО3 или SiО2. Их выбор определяется составом породы. Флюсы взаимодействуют при нагревании с породой, образуя легкоплавкие шлаки (CaSiО3 и MgSiО3). Так, если в железной руде в качестве пустой породы преобладает известняк (СаСО3) или магнезит (MgCО3), то флюсом служит SiО2. Наоборот, если пустая порода состоит из SiО2, то флюсом является СаСО3. Взаимодействие флюса с пустой породой можно выразить реакцией: SiО2+ СаСО3= CaSiО3 + СО2.
Шлаки (CaSiО3, MgSiО3 и др.) скапливаются над расплавленным чугуном и защищают его от окисления воздухом или кислородом, вдуваемыми в печь. Шлаки и чугун периодически выпускают из печи через чугунную и шлаковую летки. Для увеличения производительности доменных печей вместо воздушного дутья применяют кислородное. Уголь иногда заменяют природным газом.
В зависимости от условий охлаждения вытекающий, из домны чугун может быть белым или серым. При быстром охлаждении чугуна карбид железа (Fe3C) не успевает разложиться и поэтому получается очень твердый и хрупкий белый чугун, Серый чугун образуется при медленном охлаждении. В этом случае основная масса карбида железа разлагается с выделением графита (Fe3C = 3Fe + С). Белый чугун называют передельным, так как его перерабатывают в сталь. Серый чугун менее тверд, используется для отливок и называется литейным.
Главная масса чугуна, выплавляемого в домнах, идет на переработку в сталь и для получения ковкого железа. Переработка чугуна в сталь связана с удалением серы, фосфора, кремния, марганца и снижением содержания углерода до 2% (масс.) и менее. Углерод выжигают из чугуна в конверторах, мартеновских печах или электропечах, а другие примеси поглощаются футеровкой и уходят в шлаки. По конверторному способу расплавленный чугун из доменной печи поступает в конвертор — поворачивающийся вокруг горизонтальной оси большой сосуд, выложенный изнутри огнеупорным материалом. При продувании сильной струи воздуха происходит выгорание углерода. Дутье прекращают, не допуская его полного выгорания.
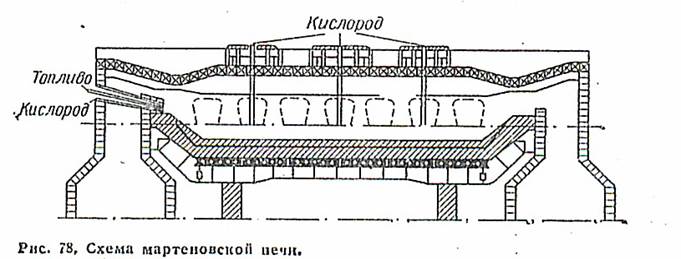
По другому способу примеси в чугуне удаляют в мартеновских печах воздухом или кислородом, которые пропускают над раскаленным чугуном (рис. 78). Окисление производят также добавляемыми к чугуну оксидами железа (железный лом, железная руда). Этим методом можно получать различные сорта стали с заданным содержанием углерода, кремния и легирующих добавок (марганца, молибдена, вольфрама и др.).
Одним из самых перспективных способов производства стали является кислородно-конверторный.
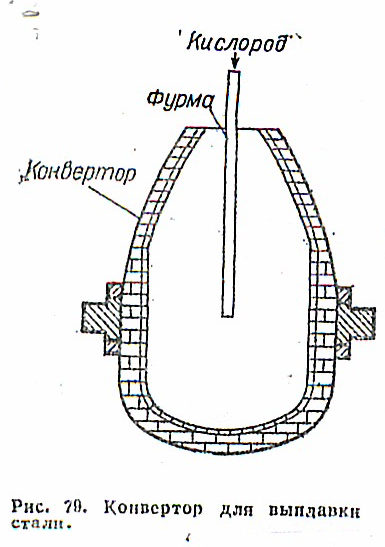 Чугун заливают в конвертор, днище которого не имеет отверстий для дутья (рис. 79). Кислород подается на поверхность жидкого чугуна. Достоинства конвертора состоят в том, что он занимает меньше места, чем мартеновская печь, сооружение • его требует меньших затрат, а производительность выше. Однако сталь, легированную несколькими элементами, в конверторах пока не получают. А в мартеновской печи можно получать сталь практически всех марок.
Чугун заливают в конвертор, днище которого не имеет отверстий для дутья (рис. 79). Кислород подается на поверхность жидкого чугуна. Достоинства конвертора состоят в том, что он занимает меньше места, чем мартеновская печь, сооружение • его требует меньших затрат, а производительность выше. Однако сталь, легированную несколькими элементами, в конверторах пока не получают. А в мартеновской печи можно получать сталь практически всех марок.
Важное значение имеют, некоторые соли железа. Железный купорос FeSО4+7H2О применяют для борьбы с вредителями сельского хозяйства, для приготовления чернил и минеральных красок. Сульфат железа(III) Fe2(SО4)3 используют как коагулянт при очистке воды. Хлорид железа FeCl3+6H2О является катализатором в некоторых химических процессах, а также может применяться в качестве протравы при крашении тканей. Соли K4[Fe(CN)6] и K3[Fe(CN)6] пригодны для обнаружения в растворах ионов Fe3+ и Fe2+ в химическом анализе.
В современной технике сплавы на основе железа продолжают играть важную роль. Производству черных металлов —чугуна и стали — уделяется большое внимание в планах развития народного хозяйства
По многим физическим свойствам никель сходен с кобальтом. Плотность его 8900 кг/м3, температура плавления 1455°С. Атомная масса никеля на 0,23 а. е. м. меньше, чем у кобальта.
В компактном виде никель устойчив по отношению к воздуху и воде, в обычных условиях заметно не реагирует даже с типичными неметаллами — кислородом, серой и галогенами. Устойчив в щелочах и в ряде кислот. Высокая коррозионная стойкость никеля обусловлена его способностью к образованию оксидных пленок, обладающих сильным защитным действием. При нагревании никель реагирует с кислородом, серой, хлором, бромом, углеродом, образуя NiO, NiS, NiCl2, NiBr2, Ni3C. Никель медленно растворяется в разбавленных растворах соляной, серной и азотной кислот.
Соединения никеля сходны с соединениями кобальта. Оксид никеля (II)—основной, представляет собой кристаллы серо-зеленого цвета. Оксид никеля(III) —основной, серо-черного цвета. Оксидам никеля соответствуют гидроксиды светло-зеленого Ni(ОН)2 и черного Ni(OH)3 цвета. Однако известен только один ряд солей никеля, в которых он проявляет степень окисления +2. В отличие от гидроксидов железа(II) и кобальта(II), Ni(ОН)2 кислородом воздуха не окисляется. Устойчивость к кислороду воздуха проявляют также и соли никеля(II). Только при действии сильных окислителей, например хлора, в щелочной среде происходит окисление гидроксида никеля(II) в гидроксид никеля(Ш):
2Ni(OH)2 + 2NaOH + CI2 = 2Ni(OH)3 + 2NaCl
По свойствам Ni(OH)3 подобен гидроксиду кобальта (III), но обладает ещё более выраженными окислительными свойствами:
2Ni(OH)3 + 6HC1 =2NiCl2 + Cl2 + 6Н2О
Никель образует много комплексных соединений. Для большинства из них характерно координационное число 6. Известны комплексные соединения никеля, во внутреннюю сферу которых в качестве лигандов одновременно входят молекулы Н2О и NH3, например
[Ni(NH3)4 (Н2O)2] Сl2,
Никель играет важную роль в производстве специальных сталей, из которых изготавливают детали автомобилей, тепловозов и т. д. Его используют в сплавах и с другими металлами, например медью, алюминием, оловом, свинцом. Сплав никеля с медью применяют для изготовления монет. Нихром — сплав, содержащий [в % (масс.)] 60 Ni и 40 Сг, — в виде проволоки применяют для обмотки электропечей и других нагревательных приборов, так как он обладает сравнительно большим электрическим сопротивлением. Сплавы константам, [состав, %(масс.): 40 Ni и 60 Си] и никелин [состав, % (масс.) з 31 Ni, 56 Си и 13 Zn] характеризуются низкими значениями электрической проводимости, почти не зависящими от температуры. Поэтому из этих сплавов изготавливают реостаты. Мелкодисперсный никель является катализатором многих химических процессов. За годы десятой пятилетки производство никеля возросло в 1,3 раза.
Из соединений никеля большое значение имеет сульфат NiSО4 + 7H2О, который используют при никелировании металлов.
§12.9. Решение экспериментальных задач по теме «Металлы. Неметаллы» Цель: применить знания, полученные при изучении темы, к объяснению проделанных вами опытов.
Необходимые оборудование и реактивы:
• штатив с пробирками; " •
• пробиркодержатель;
• ржавые гвозди;
• соляная кислота;
• серная кислота;
• концентрированная азотная кислота;
• кусочки цинка, меди;
• полоски алюминия;
; раствор хлорида ртути (II);
• сера;
• лакмусовая бумага;
• раствор нитрата свинца.
Задача № 1. Очистите железный гвоздь от ржавчины химическим способом. Выясните, какие ионы железа — Fe2+, Fe3+ - содержатся в растворе, используемом для снятия ржавчины, после проведения опыта. Перед началом опыта выскажите обоснованные предположения, какие ионы будут содержаться в растворе после снятия ржавчины. Ответ подтвердите уравнениями химических реакций и проведением указанного опыта.
Задача № 2. Очищенный железный гвоздь опустите на несколько секунд в концентрированную азотную кислоту, а затем, обмыв его водой, опустите в соляную кислоту. Второй гвоздь после обработки азотной кислотой зачистите наждачной бумагой и также опустите в соляную кислоту. Объясните роль азотной кислоты и напишите уравнение химической реакции.
Задача № 3. Положите в одну пробирку кусочек цинка, в другую — кусочек меди. В обе пробирки прилейте I мл раствора серной кислоты. Напишите уравнения химических реакций. Перед началом эксперимента на основе знаний об отношении кислот к металлам предположите, что вы будете наблюдать.
Задача № 4. Пластинку алюминия погрузите в чашечку с раствором хлорида ртути и снимите чем-либо острым поверхностный слой с металла. Затем полоску выньте из раствора, промойте водой и оставьте на воздухе. Что появляется на поверхности металла через несколько минут? К какому типу реакций относятся данные реакции? Напишите уравнения химических реакций.
Металловедение — наука, изучающая зависимость между составом, строением и свойствами металлов и сплавов и закономерности их изменения под воздействием внешних факторов: тепловых, химических, механических, электромагнитных, радиоактивных.








