3 .12.1 Определение общей кислотности воды
В коническую колбу емкостью 250 мл отмеряем пипеткой 100 мл исследуемой воды, прибавляем 3 капли фенолфталеина. Пробу титруем раствором щелочи до появления слабо-розовой окраски, не исчезающей в течение 1-2 минут. Проводим два параллельных титрования.
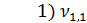 = 1,5 мл(объем щелочи, израсходованной на титрование)
= 1,5 мл(объем щелочи, израсходованной на титрование)
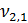 = 100 мл (объем воды, взятой для исследования)
= 100 мл (объем воды, взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора щелочи)
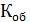 =
= 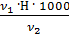 =
= 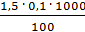 = 1,5 мг-экв/л (1)
= 1,5 мг-экв/л (1)
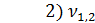 = 1,5 мл(объем щелочи, израсходованной на титрование)
= 1,5 мл(объем щелочи, израсходованной на титрование)
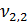 = 100 мл (объем воды, взятой для исследования)
= 100 мл (объем воды, взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора щелочи)
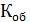 =
= 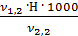 =
= 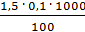 = 1,5 мг-экв/л (1)
= 1,5 мг-экв/л (1)
Рассчитываем среднюю общую кислотность
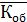 =
= 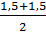 = 1,50 мг-экв/л
= 1,50 мг-экв/л
 3 .12.2 Определение общей щелочности воды
3 .12.2 Определение общей щелочности воды
В коническую колбу емкостью 250 мл отмеряем пипеткой 100 мл исследуемой воды. Прибавляем 3 капли метилоранжа и титруем раствором кислоты до перехода желтой окраски в оранжевую. Проводим два параллельных титрования.
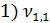 = 4,0 мл(объем кислоты, израсходованной на титрование)
= 4,0 мл(объем кислоты, израсходованной на титрование)
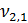 = 100 мл (объем воды, взятой для исследования)
= 100 мл (объем воды, взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора кислоты)
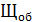 =
= 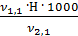 =
= 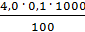 = 4,0 мг-экв/л (2)
= 4,0 мг-экв/л (2)
2) 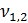 = 4,0 мл(объем кислоты, израсходованной на титрование)
= 4,0 мл(объем кислоты, израсходованной на титрование)
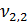 = 100 мл (объем воды, взятой для исследования)
= 100 мл (объем воды, взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора кислоты)
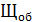 =
= 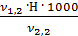 =
= 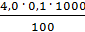 = 4,0 мг-экв/л (2)
= 4,0 мг-экв/л (2)
Рассчитываем среднюю общую щелочность
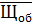 =
= 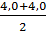 =4,0 мг-экв/л
=4,0 мг-экв/л
3 .12.3 Определение общей жесткости воды
В коническую колбу наливаем 50 мл испытуемой воды. При этом суммарное содержание ионов кальция и магния во взятом объеме воды не должно превышать 0,5 ммоль. Затем прибавляем 5 мл буферного раствора, 0,1 г сухой смеси индикатора хромогена черного с сухим хлористым натрием и сразу же титруем при сильном взбалтывании 0,05 н. раствором трилона Б до изменения окраски в эквивалентной точке. Проводим два параллельных титрования.
Окраску получили синею. Появление этого окрашивания свидетельствует об отсутствии ионов 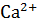 и
и 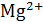 в растворе, т.е. о полном связывании их с трилоном Б.
в растворе, т.е. о полном связывании их с трилоном Б.
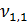 = 13,5 мл;
= 13,5 мл; 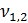 = 13,6 мл
= 13,6 мл
Общую жесткость воды вычисляют по уравнению (3)
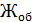 =
= 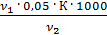
К – поправочный коэффициент к нормальной концентрации раствора трилона Б
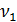 – количество трилона Б, израсходованное на титрование пробы
– количество трилона Б, израсходованное на титрование пробы
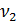 – объем воды, взятой для определения общей жесткости
– объем воды, взятой для определения общей жесткости
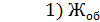 =
= 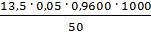 = 12,960 мг-экв/л
= 12,960 мг-экв/л
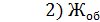 =
= 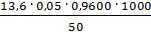 = 13,056 мг-экв/л
= 13,056 мг-экв/л
 Рассчитываем относительную погрешность
Рассчитываем относительную погрешность
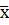 =
= 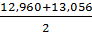 = 13,008
= 13,008
ᵟ = 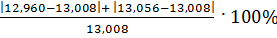 = 0,74%
= 0,74%
3.12.4 Определение рН воды с помощью стеклянного электрода
Промыть электроды и стакан для пробы дистиллированной водой. Налить в стакан для пробы исследуемый раствор. Включить прибор рН-метр. На потенциометре установить температуру раствора. Переключить mV/pH, установить в положение «рН». При помощи держателя погрузить электроды в стакан с исследуемым раствором. Запишем установившееся значение рН.
t = 25,60C
pH = 7,45
3.13 Определение показателей качества водопроводной воды с калием сернокислым кислым KHSO4








