Физико-химические показатели качества природных вод
Под качеством природной воды в целом понимается характеристика ее состава и свойств, определяющая ее пригодность для конкретных видов водопользования (ГОСТ 17.1.1.01–77), при этом критерии качества представляют собой признаки, по которым производится оценка качества воды.
Взвешенные примеси
Взвешенные твердые примеси, присутствующие в природных водах, состоят из частиц глины, песка, ила, суспендированных органических и неорганических веществ, планктона и различных микроорганизмов. Взвешенные частицы влияют на прозрачность воды. Содержание в воде взвешенных примесей, измеряемое в мг/л, дает представление о загрязненности воды частицами в основном условным диаметром более 1·10-4 мм. При содержании в воде взвешенных веществ менее 2–3 мг/л или больше указанных значений, но условный диаметр частиц меньше 1 · 10-4 мм, определение загрязненности воды производят косвенно по мутности воды.
Мутность и прозрачность
Мутность воды вызвана присутствием тонкодисперсных примесей, обусловленных нерастворимыми или коллоидными неорганическими и органическими веществами различного происхождения. Качественное определение проводят описательно: мутность не заметна (отсутствует), слабая опалесценция, опалесценция, слабо мутная, мутная и сильная муть. В России мутность чаще всего измеряют в нефелометрических единицах мутности НЕФ (NTU) для небольших значений в пределах 0–40 НЕФ (NTU), например, для питьевой воды. В условиях большой мутности обычно применяется измерение единиц мутности по формазину (ЕМФ). Пределы измерений – 40–400 ЕМФ. Индикатор по НЕФ (NTU) – рассеивание излучения, по ЕМФ – ослабление потока излучения. Наряду с мутностью, особенно в случаях, когда вода имеет незначительные окраску и мутность, и их определение затруднительно, пользуются показателем «прозрачность».
Запах
Характер и интенсивность запаха природной воды определяют органолептически. По характеру запахи делят на две группы: естественного происхождения (живущие и отмершие в воде организмы, загнивающие растительные остатки и др.); искусственного происхождения (примеси промышленных и сельскохозяйственных сточных вод). Интенсивность запаха по ГОСТ 3351-74* оценивают в шести балльной шкале. Запахи второй группы (искусственного происхождения) называют по определяющим запах веществам: хлорный, бензиновый и т.д.
Вкус и привкус
Интенсивность вкуса и привкуса в соответствии с ГОСТ 3351-74 определяется также по шести балльной шкале. Различают четыре вида вкусов: соленый, горький, сладкий, кислый. Качественную характеристику оттенков вкусовых ощущений – привкуса – выражают описательно: хлорный, рыбный, горьковатый и так далее. Наиболее распространенный соленый вкус воды чаще всего обусловлен растворенным в воде хлоридом натрия, горький – сульфатом магния, кислый – избытком свободного диоксида углерода и т.д.
Цветность
Показатель качества воды, характеризующий интенсивность окраски воды и обусловленный содержанием окрашенных соединений, выражается в градусах платино-кобальтовой шкалы и определяется путем сравнения окраски испытуемой воды с эталонами. Цветность природных вод обусловлена главным образом присутствием гумусовых веществ и соединений трехвалентного железа, колеблется от единиц до тысяч градусов.
Минерализация – суммарное содержание всех найденных при химическом анализе воды минеральных веществ. Минерализация природных вод, определяющая их удельную электропроводность, изменяется в широких пределах. Большинство рек имеет минерализацию от нескольких десятков миллиграммов в литре до нескольких сотен. Их удельная электропроводимость варьирует от 30 до 1500 мкСм/см. Минерализация подземных вод и соленых озер изменяется в интервале от 40–50 мг/л до сотен г/л (плотность в этом случае уже значительно отличается от единицы). Удельная электропроводимость атмосферных осадков с минерализацией от 3 до 60 мг/л составляет значения 10–120 мкСм/см. Согласно ГОСТ 17403-72 природные воды по минерализации разделены на группы. Предел пресных вод – 1 г/кг – установлен в связи с тем, что при минерализации более этого значения вкус воды неприятен – соленый или горько-соленый. Граница между солоноватыми и солеными водами принята на том основании, что при минерализации около 25 г/кг температура замерзания воды и температура наибольшей плотности морской воды совпадают, и при этом меняются некоторые свойства воды. Граница 50 г/кг между солеными водами и рассолами обусловлена тем, что соленость больше этого значения не бывает в морях; такая соленость характерна только для соленых озер и некоторых подземных вод.
Электропроводимость – это численное выражение способности водного раствора проводить электрический ток. Электрическая проводимость воды зависит в основном от концентрации растворенных минеральных солей и температуры. Минеральную часть воды составляют ионы Na+, K+, Ca2+, Mg2+, CI-, SO4-, HCO3-. Этими ионами и обусловливается электропроводимость природных вод. Присутствие других ионов, например Fe3+, Fe2+, Mn2+, AI3+, NO3-, HPO4-, H2PO4-, не сильно влияет на электропроводимость, если эти ионы не содержатся в воде в значительных количествах (например, ниже выпусков производственных или хозяйственно-бытовых сточных вод). По значениям электропроводимости можно приближенно судить о минерализации воды. Вода в промышленности используется в качестве универсального растворителя и теплоносителя, сырья в производстве многих продуктов, а также для бытовых нужд. В настоящие время в мире расходуется (безвозвратно) до 170 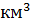 воды в год. Требования к качеству промышленных вод устанавливаются стандартами в зависимости от цели ее потребления. Соответственно, необходим контроль качества воды. В данной лабораторной работе определяются некоторые показатели качества промышленной воды.
воды в год. Требования к качеству промышленных вод устанавливаются стандартами в зависимости от цели ее потребления. Соответственно, необходим контроль качества воды. В данной лабораторной работе определяются некоторые показатели качества промышленной воды.
Кислотность природных вод обусловлена наличием угольной кислоты, а также нерастворимых солей, образованных слабым основанием и сильной кислотой. Такие соли, подвергаясь гидролизу, образуют свободную кислоту. Ее определяют методом нейтрализации, основанной на взаимодействии кислоты со щелочью. При определении кислотности природных вод в качестве рабочего раствора берут гидроксид натрия и титруют пробу воды в присутствии фенолфталеина.
Общая щелочность воды обусловлена наличием свободных гидроксидов, а также солей слабой кислоты и сильного основания. Такие соли, гидролизуясь, образуют свободные гидроксильные ионы. Щелочность также определяют методом нейтрализации.
Жесткость воды - один из важнейших и контролируемых показателей ее качества. По количеству присутствующей соли воду подразделяют на жесткую, средней жесткости и мягкую. Различают временную, постоянную и общую жесткости. Временная жесткость обусловлена присутствием в воде бикарбонатов кальция и магния, которые при нагревании разлагаются, а образующиеся малорастворимые соли выпадают в осадок. Постоянная жесткость характеризуется содержанием в воде хлоридов, сульфатов, нитратов кальция и магния, остающихся после кипячения при атмосферном давлении в растворенном состоянии. Общую жесткость находят как сумму временной и постоянной видов жесткости. Для определения общей жесткости воды используют комплексонометрический метод анализа, основанный на образовании прочных внутрикомплексных соединений ионов кальция и магния с комплексонами (в настоящей работе используют раствор трилона Б).
Определению общей жесткости воды мешают: медь, цинк, марганец и высокое содержание углекислых и двууглекислых солей. Влияние этих веществ устраняют в ходе анализа. Точность определения при титровании 100 мл пробы составляет ±0,05 ммоль/л.
Степень кислотности и щелочности воды определяет соотношение концентрации водородных и гидроксильных ионов.
Химически чистая вода диссоциирует:
Н2О ↔ 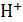 +
+ 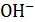
При 25 0С концентрация ионов водорода (и гидроксильных ионов) равна 1· 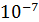 грамм-ионов. Обычно используют водородный показатель ‒ рН, числовое выражение которого равно отрицательному показателю степени при числе 10, указывающему концентрацию водородного иона
грамм-ионов. Обычно используют водородный показатель ‒ рН, числовое выражение которого равно отрицательному показателю степени при числе 10, указывающему концентрацию водородного иона
рН = ‒ lg[ 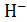 ].
].
Растворы с рН 7 имеют нейтральную реакцию, при рН >7 ‒ щелочную, а при рН<7 ‒ кислую. В природной воде рН обычно зависит от соотношения концентрации различных форм углекислоты, от присутствия органических кислот и солей, подвергающихся гидролизу. Для определения рН используют потенциометрический метод, в основе которого лежит измерение электродвижущей силы цепи, состоящей из двух электродов. В качестве электрода с нулевым потенциалом применяют водородный электрод (платиновая пластина, покрытая слоем губчатой платины и насыщенная водородом при 200С и 760 мм рт. ст.). На практике водородный электрод сравнения часто заменяют более простым в обращении ‒ каломельным, имеющим устойчивый потенциал. В настоящей работе для определения величины рН используют стеклянный электрод, составляющий гальваническую цепь с каломельным электродом.
2 Экспериментальная часть
2.1.1 Определение общей кислотности воды
В коническую колбу емкостью 250 мл отмеряют пипеткой 100 мл исследуемой воды, прибавляют 2-3 капли фенолфталеина. Пробу титруют раствором щелочи до появления слабо-розовой окраски, не исчезающей в течение 1-2 минут.
Общая кислотность рассчитывается по уравнению (1):
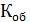 =
= 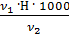 [мг-экв/л]
[мг-экв/л]
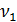 - объем щелочи, израсходованной на титрование [мл]
- объем щелочи, израсходованной на титрование [мл]
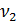 - объем воды, взятой для исследования [мл]
- объем воды, взятой для исследования [мл]
Н - нормальная концентрация рабочего раствора щелочи
2.1.2 Определение общей щелочности воды
В коническую колбу емкостью 250 мл отмеряют пипеткой 100 мл исследуемой воды. Прибавляют 2-3 капли метилоранжа и титруют раствором кислоты до перехода желтой окраски в оранжевую.
Общая щелочность рассчитывается по уравнению (2):
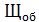 =
= 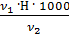 [г-экв/л]
[г-экв/л]
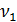 - объем кислоты, израсходованной на титрование [мл]
- объем кислоты, израсходованной на титрование [мл]
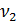 - объем воды, взятой для исследования [мл]
- объем воды, взятой для исследования [мл]
Н – нормальная концентрация рабочего раствора кислоты
2.1.3 Определение общей жесткости воды
В коническую колбу наливают 100 мл испытуемой воды или меньший объем, разбавленный до 100 мл дистиллированной водой. При этом суммарное содержание ионов кальция и магния во взятом объеме воды не должно превышать 0,5 ммоль. Затем прибавляют 5 мл буферного раствора, 5-7 капель индикатора или приблизительно 0,1 г сухой смеси индикатора хромогена черного с сухим хлористым натрием и сразу же титруют при сильном взбалтывании 0,05 н. раствором трилона Б до изменения окраски в эквивалентной точке (окраска должна быть синей с зеленоватым оттенком).
Общая жесткость рассчитывается по уравнению (3):
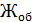 =
= 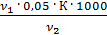 [мг-экв/л]
[мг-экв/л]
К – поправочный коэффициент к нормальной концентрации раствора трилона Б
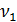 – количество трилона Б, израсходованное на титрование пробы
– количество трилона Б, израсходованное на титрование пробы
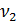 – объем воды, взятой для определения общей жесткости
– объем воды, взятой для определения общей жесткости
2.1.4 Определение рН воды с помощью стеклянного электрода
1. Промыть электроды и стакан для пробы дистиллированной водой.
2. Налить в стакан для пробы исследуемый раствор.
3. Включить прибор рН-метр.
4. На потенциометре установить температуру раствора.
5. Переключить mV/pH, установить в положение «рН».
6. При помощи держателя погрузить электроды в стакан с исследуемым раствором.
7. Записать установившееся значение рН.
8. По окончанию измерений промыть электроды дистиллированной водой.
2.2 Оборудование, посуда, химические реактивы:
Аналитические весы GX‒200
рН-метр/иономер ИПЛ‒102
штатив, держатели (титровальная установка)
Конические колбы – 250 мл
Пипетки Мора – 5 мл, 50 мл
Бюретка – 25 мл
Спринцовка
Мерная колба – 1000 мл, 500 мл
NaOH – 0,1 н
Фенолфталеин – 1%-й раствор в 60%-м водном спиртовом растворе
HCI ‒ 0,1 н
Метиловый оранжевый ‒ 0,03%-й раствор
Раствор трилона Б ‒ 0,05 н
Буферный раствор
Хромоген черный с хлористым натрием
2.3 Приготовление растворов
ЭДТА 0,05 н – получаем из раствора ЭДТА 0,05 моль/л. Для этого в 250 мл ЭДТА 0,05 моль/л добавляем 250 мл дистиллированной воды.








