Медиаторы нервной системы
Из вышеизложенного понятно, какое значение в функциях нервной системы играют медиаторы. В ответ на приход нервного импульса к синапсу происходит выброс медиатора; молекулы медиатора соединяются (комплементарно - как «ключ к замку») с рецепторами постсинаптической мембраны, что приводит к открыванию ионного канала или к активированию внутриклеточных реакций. Примеры синаптической передачи, рассмотренные выше, полностью соответствуют этой схеме. Вместе с тем благодаря исследованиям последних десятилетий эта довольно простая схема химической синаптической передачи значительно усложнилась. Появление иммунохимических методов позволило показать, что в одном синапсе могут сосуществовать несколько групп медиаторов, а не один, как это предполагали раньше. Например, в одном синаптическом окончании одновременно могут находиться синаптические пузырьки, содержащие ацетилхолин и норадреналин, которые довольно легко идентифицируются на электронных фотографиях (ацетилхолин содержится в прозрачных пузырьках диаметром около 50 нм, а норадреналин - в электронно-плотных диаметром до 200 нм). Кроме классических медиаторов, в синаптическом окончании могут находиться один или несколько ней-ропептидов. Количество веществ, содержащихся в синапсе, может доходить до 5-6 (своеобразный коктейль). Более того, медиаторная специфичность синапса может меняться в онтогенезе. Например, нейроны симпатических ганглиев, иннервирующие потовые железы у млекопитающих, исходно норадренергичны, но у взрослых животных становятся холинергичными.
В настоящее время при классификации медиаторных веществ принято выделять: первичные медиаторы, сопутствующие медиаторы, медиаторы-модуляторы и аллостерические медиаторы. Первичными медиаторами считают те, которые действуют непосредственно на рецепторы постсинаптической мембраны. Сопутствующие медиаторы и медиаторы-модуляторы могут запускать каскад ферментативных реакций, которые, например, фосфорилируют рецептор для первичного медиатора. Аллостерические медиаторы могут участвовать в кооперативных процессах взаимодействия с рецепторами первичного медиатора.
Долгое время за образец принимали синаптическую передачу по анатомическому адресу (принцип «точка - в точку»). Открытия последних десятилетий, особенно медиаторной функции нейропептидов, показали, что в нервной системе возможен принцип передачи и по химическому адресу. Другими словами, медиатор, выделяющийся из данного окончания, может действовать не только на «свою» постсинаптическую мембрану, но и за пределами данного синапса - на мембраны других нейронов, имеющих соответствующие рецепторы. Таким образом, физиологическая реакция обеспечивается не точным анатомическим контактом, а наличием соответствующего рецептора на клетке-мишени. Собственно этот принцип был давно известен в эндокринологии, а исследования последних лет нашли ему более широкое применение.
Все известные типы хеморецепторов на постсинаптической мембране разделяют на две группы. В одну группу входят рецепторы, в состав которых включен ионный канал, открывающийся при связывании молекул медиатора с «узнающим» центром. Рецепторы второй группы (метаботропные рецепторы) открывают ионный канал опосредованно (через цепочку биохимических реакций), в частности, посредством активации специальных внутриклеточных белков.
Одними из самых распространенных являются медиаторы, принадлежащие к группе биогенных аминов. Эта группа медиаторов достаточно надежно идентифицируется микрогистологическими методами. Известны две группы биогенных аминов: катехоламины (дофамин, норадреналин и адреналин) и индоламин (серотонин). Функции биогенных аминов в организме весьма многообразны: медиаторная, гормональная, регуляция эмбриогенеза.
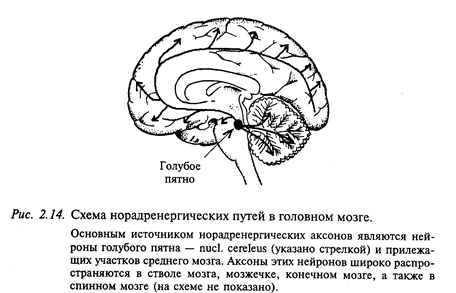
Основным источником норадренергических аксонов являются нейроны голубого пятна и прилежащих участков среднего мозга (рис. 2.14). Аксоны этих нейронов широко распространяются в мозговом стволе, мозжечке, в больших полушариях. В продолговатом мозге крупное скопление норадренергических нейронов находится в вентролатеральном ядре ретикулярной формации. В промежуточном мозге (гипоталамусе) норадренергические нейроны наряду с дофаминергическими нейронами входят в состав гипоталамо-гипофизарной системы. Норадренергические нейроны в большом количестве содержатся в нервной периферической системе. Их тела лежат в симпатической цепочке и в некоторых интрамуральных ганглиях.
Дофаминергические нейроны у млекопитающих находятся преимущественно в среднем мозге (так называемая нигро-неостриарная система), а также в гипоталамической области. Дофаминовые цепи мозга млекопитающих хорошо изучены. Известны три главные цепи, все они состоят из однонейронной цепочки. Тела нейронов находятся в мозговом стволе и отсылают аксоны в другие области головного мозга (рис. 2.15).
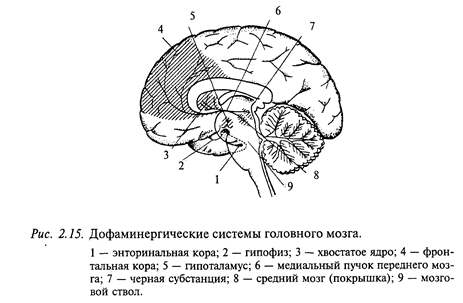
Одна цепь очень проста. Тело нейрона находится в области гипоталамуса и отсылает короткий аксон в гипофиз. Этот путь входит в состав гипоталамо-гипофизарной системы и контролирует систему эндокринных желез.
Вторая дофаминовая система также хорошо изучена. Это черная субстанция, многие клетки которой содержат дофамин. Аксоны этих нейронов проецируются в полосатые тела. Эта система содержит примерно 3/4 дофамина головного мозга. Она имеет решающее значение в регулировании тонических движений. Дефицит дофамина в этой системе приводит к болезни Паркинсона. Известно, что при этом заболевании происходит гибель нейронов черной субстанции. Введение L-DOPA (предшественника дофамина) облегчает у больных некоторые симптомы заболевания.
Третья дофаминергическая система участвует в проявлении шизофрении и некоторых других психических заболеваний. Функции этой системы пока изучены недостаточно, хотя сами пути хорошо известны. Тела нейронов лежат в среднем мозге рядом с черной субстанцией. Они проецируют аксоны в вышележащие структуры мозга, мозговую кору и лимбическую систему, особенно к фронтальной коре, к септальной области и энторинальной коре. Энторинальная кора, в свою очередь, является главным источником проекций к гиппокампу.
Согласно дофаминовой гипотезе шизофрении, третья дофаминергическая система при этом заболевании сверхактивна. Эти представления возникли после открытия веществ, снимающих некоторые симптомы заболевания. Например, хлорпромазин и галоперидол имеют разную химическую природу, но они одинаково подавляют активность дофаминергической системы мозга и проявление некоторые симптомов шизофрении. У больных шизофренией, в течение года получавших эти препараты, появляются двигательные нарушения, получившие название tardive dyskinesia (повторяющиеся причудливые движения лицевой мускулатуры, включая мускулатуру рта, которые больной не может контролировать).
Серотонин почти одновременно открыли в качестве сывороточного сосудосуживающего фактора (1948) и энтерамина, секретируемого энтерохромаффиновыми клетками слизистой оболочки кишечника. В 1951 г. было расшифровано химическое строение серотонина и он получил новое название - 5-гидрокситриптамин. В организме млекопитающих он образуется гидроксилированием аминокислоты триптофана с последующим декарбоксилированием. 90% серотонина образуется в организме энтерохромаффиновыми клетками слизистой оболочки всего пищеварительного тракта. Внутриклеточный серотонин инактивируется моноаминоксидазой, содержащейся в митохондриях. Серотонин внеклеточного пространства окисляется перулоплазмином. Большая часть вырабатываемого серотонина связывается с кровяными пластинками и по кровяному руслу разносится по организму. Другая часть действует в качестве местного гормона, способствуя авторегулированию кишечной перистальтики, а также модулируя эпителиальную секрецию и всасывание в кишечном тракте.
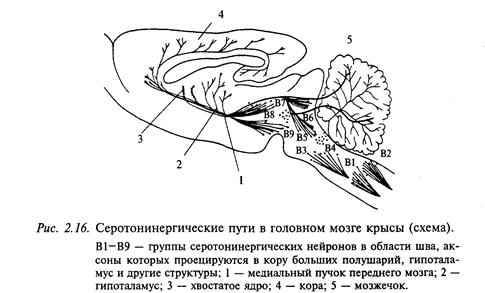
Серотонинергические нейроны широко распространены в центральной нервной системе (рис. 2.16). Они обнаруживаются в составе дорсального и медиального ядер шва продолговатого мозга, а также в среднем мозге и варолиевом мосту. Серотонинергические нейроны иннервируют обширные области мозга, включающие кору больших полушарий, гиппокамп, бледный шар, миндалину, область гипоталамуса. Интерес к серотонину был привлечен в связи с проблемой сна. При разрушении ядер шва животные страдали бессонницей. Сходный эффект оказывали вещества, истощающие хранилище серотонина в мозге.
Самая высокая концентрация серотонина обнаружена в эпифизе (pineal gland). Серотонин в эпифизе превращается в мелатонин, который участвует в пигментации кожи, а также влияет у многих животных на активность женских гонад. Содержание как серотонина, так и мелатонина в эпифизе контролируется циклом свет - темнота через нервную симпатическую систему.
Другую группу медиаторов ЦНС составляют аминокислоты. Уже давно известно, что нервная ткань с ее высоким уровнем метаболизма содержит значительные концентрации целого набора аминокислот (перечислены в порядке убывания): глутаминовой кислоты, глутамина, аспарагиновой кислоты, гамма-аминомасляной кислоты (ГАМК).
Глутамат в нервной ткани образуется преимущественно из глюкозы. У млекопитающих больше всего глутамата содержится в конечном мозге и мозжечке, где его концентрация примерно в 2 раза выше, чем в стволе мозга и спинном мозге. В спинном мозге глутамат распределен неравномерно: в задних рогах он находится в большей концентрации, чем в передних. Глутамат является одним из самых распространенных медиаторов в ЦНС.
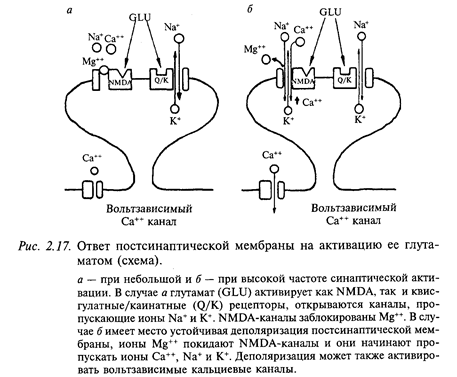
Постсинаптические рецепторы к глутамату классифицируются в соответствии с аффинностью (сродством) к трем экзогенным агонистам - квисгулату, каинату и N-метил-D-аспартату (NMDA). Ионные каналы, активируемые квисгулатом и каинатом, подобны каналам, которые управляются никотиновыми рецепторами - они пропускают смесь катионов (Na+ и. К+). Стимуляция NMDA-рецепторов имеет сложный характер активации: ионный ток, который переносится не только Na+ и К+, но также Са++ при открывании ионного канала рецептора, зависит от потенциала мембраны. Вольтзависимая природа этого канала определяется разной степенью его блокирования ионами Mg++ с учетом уровня мембранного потенциала. При потенциале покоя порядка - 75 мВ ионы Mg++, которые преимущественно находятся в межклеточной среде, конкурируют с ионами Са++ и Na+ за соответствующие каналы мембраны (рис. 2.17). Вследствие того, что ион Mg++ не может пройти через пору, канал блокируется всякий раз, как попадает туда ион Mg++. Это приводит к уменьшению времени открытого канала и проводимости мембраны. Если мембрану нейрона деполяризовать, то количество ионов Mg++, которые закрывают ионный канал, снижается и через канал беспрепятственно могут проходить ионы Са++, Na+ и. К+. При редких стимуляциях (потенциал покоя изменяется мало) глутаматергического рецептора ВПСП возникает преимущественно за счет активации квисгулатных и каинатных рецепторов; вклад NMDA-рецепторов незначителен. При длительной деполяризации мембраны (ритмическая стимуляция) магниевый блок удаляется, и NMDA-каналы начинают проводить ионы Са++, Na+ и. К+. Ионы Са++ через вторичные посредники могут потенцировать (усиливать) минПСП, что может привести, например, к длительному увеличению синаптической проводимости, сохраняющейся часами и даже сутками.
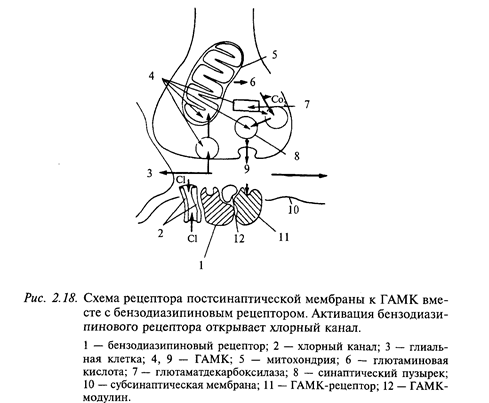
Из тормозных медиаторов ГАМК является самой распространенной в ЦНС. Она синтезируется из L-глутаминовой кислоты в одну стадию ферментом декарбоксилазой, наличие которой является лимитирующим фактором этого медиатора. Известно два типа ГАМК-рецепторов на постсинаптической мембране: ГАМКА (открывает каналы для ионов хлора) и ГАМКБ (открывает в зависимости от типа клетки каналы для. К+ или Са++). На рис. 2.18 показана схема ГАМК-рецептора. Интересно, что в его состав входит бензодиазипиновый рецептор, наличием которого объясняют действие так называемых малых (дневных) транквилизаторов (седуксена, тазепама и др.). Прекращение действия медиатора в ГАМК-синапсах происходит по принципу обратного всасывания (молекулы медиатора специальным механизмом поглощаются из синаптической щели в цитоплазму нейрона). Из антагонистов ГАМК хорошо известен бикукулин. Он хорошо проходит через гематоэнцефалический барьер, оказывает сильное воздействие на организм даже в малых дозах, вызывая конвульсии и смерть. ГАМК обнаруживается в ряде нейронов мозжечка (в клетках Пуркинье, клетках Гольджи, корзинчатых клетках), гиппокампа (в корзинчатых клетках), в обонятельной луковице и черной субстанции.
Идентификация ГАМК-цепей мозга трудна, так как ГАМК - обычный участник метаболизма в ряде тканей организма. Метаболическая ГАМК не используется как медиатор, хотя в химическом отношении их молекулы одинаковы. ГАМК определяется по ферменту декарбоксилазы. Метод основан на получении у животных антител к декарбоксилазе (антитела экстрагируют, метят и вводят в мозг, где они связываются с декарбоксилазой).
Другим известным тормозным медиатором является глицин. Глицинергические нейроны находятся главным образом в спинном и продолговатом мозге. Считают, что эти клетки выполняют роль тормозных интернейронов.
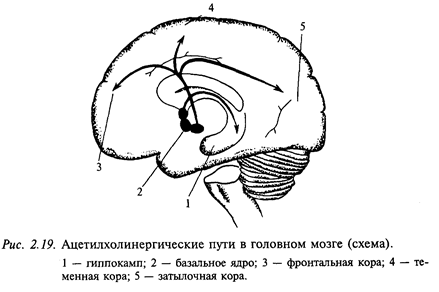
Ацетилхолин - один из первых изученных медиаторов. Он чрезвычайно широко распространен в нервной периферической системе. Примером могут служить мотонейроны спинного мозга и нейроны ядер черепных нервов. Как правило, холинергические цепи в мозге определяют по присутствию фермента холинэстеразы. В головном мозге тела холинергических нейронов находятся в ядре перегородки, ядре диагонального пучка (Брока) и базальных ядрах. Нейроанатомы считают, что эти группы нейронов формируют фактически одну популяцию холинергических нейронов: ядро педнего мозга, nucleus basalis (оно расположено в базальной части переднего мозга) (рис. 2.19). Аксоны соответствующих нейронов проецируются к структурам переднего мозга, особенно в новую кору и гиппокамп. Здесь встречаются оба типа ацетилхолиновых рецепторов (мускариновые и никотиновые), хотя считается, что мускариновые рецепторы доминируют в более рострально распоженных мозговых структурах. По данным последних лет складывается впечатление, что ацетилхолиновая система играет большую роль в процессах, связанных с высшими интегративными функциями, которые требуют участия памяти. Например, показано, что в мозге больных, умерших от болезни Альцгеймера, наблюдается массивная утрата холинергических нейронов в nucleus basalis.
ОПИАТНЫЕ РЕЦЕПТОРЫ И ОПИОИДЫ МОЗГА
Морфин и кодеин - два активных ингредиента морфия. Морфин был очищен в XIX веке и стал широко применяться в медицине. Механизм действия морфина на мозг довольно хорошо изучен благодаря тому, что было синтезировано вещество налоксон, которое является специфическим антагонистом морфина. Сам по себе налоксон неактивен, но действие введенного на его фоне морфина не проявляется. То, что налоксон имеет химическую отруктуру, похожую на морфин, и является его специфическим антагонистом, предполагает наличие на мембране специфических для морфина рецепторов. Использование меченого налоксона показало его специфическое связывание на рецепторах нейронов областей мозга, имеющих отношение к боли. Из мозга голубей было выделено вещество, получившее название энкефалин (т. е. морфин мозга), обладающее свойством морфина. В дальнейшем были открыты другие опиоиды мозга. Эту группу веществ в целом называют эндорфинами.
В настоящее время установлено, что синтез нейропептидов состоит в образовании относительно больших пептидов-предшественников, из которых после завершения трансляции выщепляются протеазами соответствующие нейропептиды. В состав такого пептида-предшественника входят обычно несколько последовательностей нейропептидов, а также так называемая сигнальная последовательность, способствующая миграции предшественника в цитоплазме клетки, после того как его синтез закончился на мембранах эндоплазматического ретикулума. В настоящее время известны следующие нейропептиды: 1) опиоидные пептиды - энкефалины, эндорфины, динорфины; 2) тахикинины-вещество Р, иейрокинин А, нейромедин К; 3) нейротензин; 4) вазоактивный интестинальный полипептид; 5) соматостатин; 6) холицистокинин; 7) нейропептид Y; 8) гастрин; 9) вазопрессин; 10) окситоцин; 11) бомбезин; 12) тиротропин; 13) ангиотензин.
Вопросы
1. Основные органеллы клетки.
2. Какие отростки имеет нейрон?
3. Какова функция глиальных клеток?
4. Потенциал покоя и потенциал действия - ионные механизмы.
5. Последовательность событий в синаптическом проведении.
6. Медиаторы и их распространение в центральной нервной системе.
Литература
Нейрохимия/Поа ред. И. П. Ашмарина и П. В. Стукаловой. М.: Изд-во Ин-та биомедицинской химии РАМН РФ, 1996..
Ходжкин А. Нервный импульс. М.: ИЛ, 1965
Шулъговский В. В. Физиология центральной нервной системы: Учебник для университетов Изд-во Моск. ун-та, 1987.
ЭкклсДж. Физиология синапсов. М.: Мир, 1966.
Глава 3
АКТИВИРУЮЩИЕ СИСТЕМЫ МОЗГА
ФИЗИОЛОГИЧЕСКИЕ МЕХАНИЗМЫ СНА
Природа сна постоянно интересует врачей, ученых разных специальностей-биологов, психологов, философов, да и простых людей. Величайшие мыслители уже давно обсуждали эту проблему. Великий врач древности Гиппократ полагал, что сон возникает в результате оттока крови и тепла во внутренние области тела. Другой великий античный ученый Аристотель (384 -322 гг. до н. э.) объяснял сон тем, что пары, возникающие при переваривании пищи в желудке, разносятся по всему телу через гуморы (жидкости), вызывая сон. Это объяснение владело умами европейских ученых и принималось на веру почти две тысячи лет.
Несмотря на то, что все высшие позвоночные животные спят, а человек проводит во сне не менее трети своей жизни, природа и назначение этого состояния оставались неизвестными на протяжении веков. Хорошо известна была лишь витальная (жизненная, от лат. vita - жизнь) необходимость сна. Сон улучшает настроение, память, восстанавливает работоспособность человека. Психиатры всегда подчеркивали, что расстройство сна нередко является первым симптомом (признаком) психического заболевания. Современное состояние этой проблемы определяется открытиями в науке начала XX века. В свою очередь, эти открытия стали возможны благодаря созданию новых методов исследования. Прежде всего это методы полиграфической регистрации физиологических процессов во время сна (т.е. одновременной регистрации нескольких физиологических функций работы сердца, дыхания, мозга). Большую роль сыграли также методы биохимического анализа биологически активных веществ, участвующих в процессах сна, и, наконец, психологические исследования, благодаря которым стремительно накапливались новые данные, однако интегрировать их в целостную концепцию оказалось весьма непросто.
Теперь уже стало очевидным, что сон высших млекопитающих, включая человека, представляет собой не просто покой, т. е. отсутствие активности, а особое состояние нервной высшей деятельности, и это состояние не однородно. Краткая история вопроса такова. В лаборатории И. П. Павлова (начало XX века) было отмечено: если собакам предъявляли монотонные раздражители, например многократное повторение легкого прикосновения (касалкой) к коже бедра задней лапы, это вызывало у животных сонливость, и они часто засыпали. Из этого наблюдения был, сделал вывод, что сон представляет собой широко разлившееся торможение (условное) по коре больших полушарий. Назначение такого торможения состоит в защите головного мозга собаки от монотонных раздражителей. Говоря о представлениях павловской школы о сне, нельзя не упомянуть случай, который приводился И. П. Павловым для иллюстрации своей концепции. В Германии в клинику профессора Штрюмпеля поступил больной, который в результате травмы потерял зрение и слух, вернее - у него слышало одно ухо и сохранились остатки зрения в одном глазу. Когда эти оба «окна в мир» закрывали, больной засыпал. В дальнейшем в лаборатории И. П. Павлова были проведены опыты на собаках, подтвердившие наблюдения, сделанные в клинике профессора Штрюмпеля. И. П. Павлов пришел к выводу, что если исключить постоянный приток импульсов в кору больших полушарий от органов чувств,- наступает сон.
Решающее значение в понимании нейрофизиологических механизмов сна имели работы по исследованию биоэлектрических процессов головного мозга животных и человека. В начале нашего столетия Г. Бергер (1905) зарегистрировал от головного мозга человека, находящегося в спокойном состоянии, синусоидальные колебания электрического потенциала с частотой 8-11 Гц. Этот ритм получил название альфа-ритма. Альфа-ритм наиболее выражен в затылочных областях головного мозга и регистрируется в состоянии спокойного бодрствования с закрытыми глазами. Это открытие было началом применения электрофизиологического метода исследования к деятельности головного мозга человека.
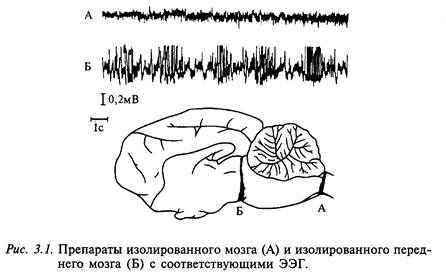
В 30-х годах нашего столетия стало известно, что перерезка у кошки мозгового ствола на уровне среднего мозга (препарат спящего мозга) вызывает сон. Этот факт был хорошо известен врачам, и они называли это состояние комой (от греч. coma - сон). Такой сон у кошки сопровождался медленными электрическими колебаниями на ЭЭГ (так называемые сонные веретена). При перерезке мозга кошки на уровне первых шейных сегментов, т. е. отделение спинного мозга от головного, получали препарат бодрствующего мозга, т. е. кошка следила глазами за движущимися перед ней объектами, шевелила вибриссами, а на ЭЭГ регистрировали быстрые колебания с частотой бета-ритма (рис. 3.1). Совокупность этих данных привела исследователей к заключению, что структуры мозгового ствола осуществляют функцию пробуждения (arousal) головного мозга. Оказалось, что если у дремлющей кошки через специальные электроды, вживленные в область мозгового ствола, производить электрическую стимуляцию ретикулярной формации, то это приводит к мгновенному пробуждению животного и настораживанию.
Какие же структуры мозгового ствола кошки могут быть ответственны за состояние бодрствования? Это структуры ретикулярной формации, или сетчатой формации. Ретикулярная формация мозгового ствола была описана еще в прошлом столетии русским ученым В. М. Бехтеревым (1898) и испанским ученым Рамон-и-Кахалем (1909) как диффузное скопление нейронов, пронизанное многочисленными нервными волокнами и занимающее срединное положение в мозговом стволе. В настоящее время в составе ретикулярной формации мозга человека описано более 100 ядер.
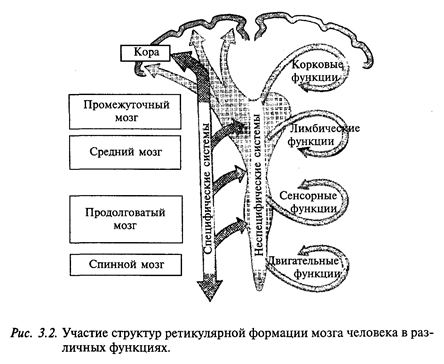
Для ретикулярной формации характерным является то, что многочисленные нейроны образуют как бы диффузную сеть (лат. Reticulae - сеть, отсюда и название всей структуры головного мозга), которая пронизана большим числом волокон, идущих от сенсорных ядер мозгового ствола (ядра черепных нервов). Аксоны нейронов ретикулярной формации направляются вверх к коре больших полушарий, а также вниз к нейронам спинного мозга (рис. 3.2). Более того, сама ретикулярная формация мозгового ствола получает волокна от ряда структур головного мозга, в том числе от коры больших полушарий, и спинного мозга. Сейчас принята гипотеза, что в норме «ретикулярный разряд» запускает корковые механизмы бодрствования, которые, в свою очередь, регулируют тонус ретикулярной формации ствола. Основываясь на этом, можно объяснить и результаты опытов в лаборатории И.П.Павлова, когда собаки засыпали при действии монотонных раздражителей.
Эти раздражители возбуждают нейроны коры, которые, воздействуя на ретикулярную формацию ствола, и приводят к засыпанию собаки.
Действительно, оказалось, что в состав ретикулярной формации мозгового ствола входят не только структуры, при возбуждении которых животное просыпается и становится активным (настораживание, принюхивание и пр.), но и структуры, активация которых вызывает засыпание животного. Это ядра шва. В окончаниях своих аксонов (синапсах) нейроны этих ядер выделяют серотонин. В опытах на животных было показано, что локальное разрушение этих ядер приводит к хронической бессоннице животного, которая может заканчиваться смертью. Известно, что истощение серотонина мозга у человека также приводит к хронической бессоннице.
В настоящее время известно, что сон не является однородным состоянием головного мозга. В 1953 г. американские исследователи Азеринский и Клейтман открыли феномен «быстрого сна». Этот феномен состоял в том, что медленноволновый сон (замедление колебаний ЭЭГ до 2-3 в секунду) периодически прерывался короткими периодами низкоамплитудной ЭЭГ высокой частоты (до 30-40 колебаний в секунду), что сопровождалось быстрыми движениями глазных яблок за закрытыми веками. Отсюда часто употребляемое название этой стадии - REM-стадия (от англ. repid eye movement). Таким образом, сейчас принято выделять, по крайней мере две стадии сна - «медленный» сон и «быстрый» сон. В этих терминах отражен характер частоты колебаний ЭЭГ человека в эти периоды. Согласно данным нейрофизиологических исследований «медленный» сон запускается ядрами шва. Эта цепочка ядер, содержащих серотонинергические нейроны, протянулась по средней линии через весь мозговой ствол от продолговатого до среднего мозга. Как уже указывалось, торможение синтеза серотонина в головном мозге приводит к бессоннице, которую можно прекратить введением умеренных доз 5-гидроокситриптофана (предшественника серотонина). Разрушение ядер шва также приводит к хронической бессоннице.
В настоящее время хорошо известно, как протекает сон человека. Переход человека от бодрствования ко сну проходит несколько стадий (рис. 3.3). Эти стадии надежно определяются по ЭЭГ, а также психологическому состоянию человека.
Стадия I (А-стадия) дремота (на ЭЭГ- медленные волны и отдельные вспышки альфа-ритма).
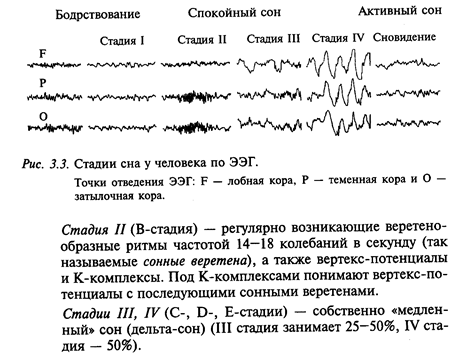
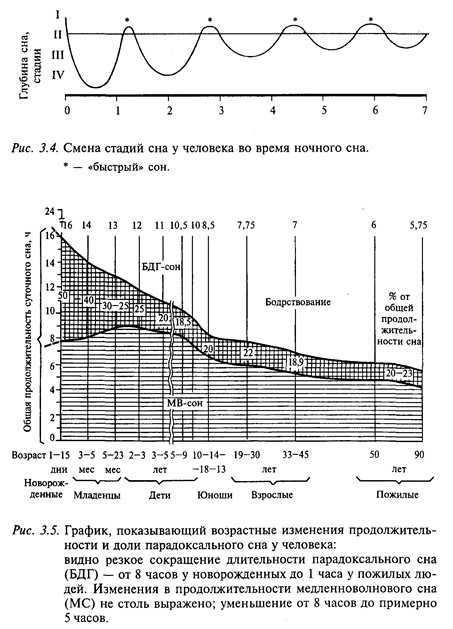
Весь ночной сон человека состоит из 4-5 циклов, каждый из которых начинается с периода «медленного» сна и завершается периодом «быстрого» сна (рис. 3.4). Длительность такого цикла относительно постоянна и у здорового человека составляет 90-100 мин. Структура ночного сна взрослого здорового человека также относительно постоянна: на «медленный» (дельта-сон) приходится 20-30%, на «быстрый» - 15-25%.
Период сна здорового взрослого человека принято делить на несколько стадий. Соотношение фаз сна в онтогенезе человека закономерно меняется (рис. 3.5). У новорожденных парадоксальная фаза сна занимает около 50% времени суток. По мере взросления длительность парадоксальной фазы сна снижается и составляет у взрослого человека 20-23%.
При избирательной депривации дельта-сна в восстановительную ночь увеличивается длительность III и IV стадий сна. Если человека полностью лишать сна, то в первую очередь увеличивается длительность дельта-сна, он быстрее наступает, и лишь на вторую ночь происходит компенсаторное увеличение длительности«быстрого» сна.
. Можно думать, что человек, прежде всего, нуждается в медленноволновом сне. Установлено, что удлинение IV стадии сна улучшает запоминание вербального материала. При увеличении нагрузки на зрительный анализатор длительность дельта-сна увеличивается. Подобные данные получены и при исследовании «быстрого» сна. Результаты экспериментов по избирательной депривации «быстрого» сна свидетельствуют о высокой потребности человека в нем. Лишение человека «быстрого» сна приводит к значительным нарушениям психики: повышаются раздражительность и эмоциональная расторможенность, появляются галлюцинации, а при углублении этого состояния могут появиться параноидальные (навязчивые) идеи. Поскольку период «быстрого» сна обычно связывают со сновидениями, то приведенные выше результаты в некоторой степени согласуются с психоаналитической концепцией о роли сновидений в регуляции психической жизни. Есть сведения, что чем более интенсивны движения глаз во время «быстрого» сна, тем лучше воспроизводятся сновидения. Этому противоверечат некоторые другие данные, например у слепорожденных движения глаз в «быстром» сне также возможны, но зрительные сновидения отсутствуют.








