Химическое равновесие
Реакции, которые протекают одновременно в прямом и обратном направлениях, называются обратимыми.
Например:
mА + nВ ↔ рD + gF.
По мере протекания реакции, в соответствии с законом действующих масс, скорость прямой реакции убывает, а скорость обратной увеличивается. В какой-то момент времени они выравниваются, т.е.
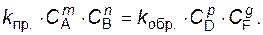 (1)
(1)
Такое состояние системы называется состоянием равновесия. При равновесии концентрации всех участников реакции постоянны и не изменяются со временем, хотя процесс не прекращается, и одновременно протекают как прямая, так и обратная реакции.
Из выражения (1) получается, что
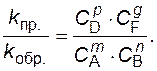 (2)
(2)
Отношение постоянных kпр. и kобр. – есть величина постоянная. Ее обозначают K и называют концентрационной константой химического равновесия:
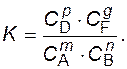 (3)
(3)
Смысл этого уравнения можно выразить так: для одной и той же температуры отношение произведений равновесных концентраций продуктов и исходных веществ, взятых в степенях их стехиометрических коэффициентов, представляет постоянную величину, называемую константой равновесия.
Это вторая формулировка закона действующих масс (для обратимых процессов).
Большое значение константы равновесия указывает на то, что равновесие наступило, когда образовалось большое количество конечных продуктов.
Изменение условий (концентраций реагирующих веществ, температуры, давления) приводит к нарушению равновесия. Скорости прямой и обратной реакции приобретают различные значения. Но через некоторое время устанавливается новое состояние равновесия. Переход системы из одного состояния в другое называется смещением химического равновесия.
Смещение химического равновесия подчиняется принципу Ле Шателье–Брауна: если изменить одно из условий, при которых система находится в состоянии равновесия (концентрацию, температуру, давление), то равновесие сдвигается в сторону, ослабляющую произведенное воздействие. Так, увеличение давления способствует реакции, идущей с уменьшением объема.
В реакции синтеза аммиака:
N2 + 3Н2 ↔ 2NН3,
увеличение давления вызывает смещение равновесия вправо, так как прямая реакция идет с уменьшением числа молей газа.
Повышение температуры смещает равновесие в сторону эндотермической реакции, а охлаждение системы – в сторону экзотермической.
Экспериментальная часть








