Опыт 5. Гетерогенный катализ
Проделать опыт 4, взяв в качестве катализатора оксид ванадия (V), не более 0,1 г. Уровень воды в бюретке отмечать каждую минуту, пока объем кислорода, выделяющегося за минуту, будет не более 0,1 мл.
Опыт 6. Автокатализ
Автокаталитическими называют реакции, катализатором в которых служит один из продуктов реакции. Примером является окисление щавелевой кислоты перманганатом в кислой среде:
2MnO4– + 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2↑ + 8H2O.
Катализатором этой реакции служат ионы Mn2+. Скорость наиболее медленной реакции – процесса образования ионов Mn3+
MnO4– + Mn2+ + 8H+ = 2Mn3+ + 4H2O –
является определяющей скорость всего процесса.
Щавелевая кислота окисляется ионами Mn3+:
H2C2O4 + 2Mn3+ = 2CO2↑ + 2Mn2+ + 2H+.
В две пробирки налить по 1-2 мл разбавленного раствора перманганата калия, подкислить раствором серной кислоты и прилить равные объемы 1 М раствора щавелевой кислоты. В одну из пробирок бросить кристаллик соли марганца (II). Сравнить скорость окисления щавелевой кислоты в обеих пробирках.
Опыт 7. Ингибирование коррозии
В два стаканчика поместить по железному гвоздю и прилить по несколько миллилитров соляной кислоты. В один из стаканов добавить 1-2 мл 40 %-ного раствора формалина. Сравнить скорость коррозии металла в обоих стаканчиках. Написать уравнение реакции.
Опыт 8. Изучение скорости гидролиза сложного эфира
в кислой среде
В качестве примера реакции гидролиза сложного эфира рассмотрим реакцию:
СН3СООС2Н5 + Н2О → СН3СООН + C2H5OH.
В разбавленных растворах эфира вследствие большого избытка воды гидролиз протекает практически полностью, но крайне медленно. Поскольку процесс катализируется ионами Н3О+, то реакцию проводят в кислой среде. Т.к. в результате самой реакции образуется кислота (уксусная), то гидролиз можно считать автокаталитическим процессом, что усложняет течение реакции. Однако, если начальная концентрация ионов водорода велика, то увеличение ее в ходе реакции будет относительно небольшим. Поэтому реакцию проводят в присутствии значительного количества сильной кислоты (например, HCl). Мерой скорости реакции является скорость расхода эфира, или, что, то же, скорость образования уксусной кислоты. Концентрация последней определяется титрованием одинаковых аликвот (5-10 мл) реакционной смеси, отобранных через определенные промежутки времени от начала реакции, раствором щелочи. В ходе реакции количество щелочи, идущее на титрование, будет увеличиваться, что связано с увеличением количества уксусной кислоты по мере протекания реакции. Мерой средней скорости w на середине данного временного отрезка является прирост объема затраченной щелочи за данный промежуток времени:
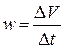
Введем обозначения:
C0 - начальная концентрация эфира;
C - концентрация эфира в данный момент времени;
Cx - концентрация прореагировавшего эфира (равна концентрации образовавшейся уксусной кислоты);
V0, Vt, и V∞ - объемы щелочи (в мл), идущие на титрование отобранной аликвоты в начале реакции, в момент времени t и после окончания реакции, соответственно.
Так как начальная концентрация эфира C0 пропорциональна разности 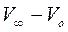 , а концентрация эфира в данный момент времени
, а концентрация эфира в данный момент времени 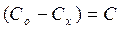 , пропорциональна
, пропорциональна 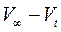 , то кинетическое уравнение
, то кинетическое уравнение
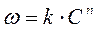
преобразуется к виду: 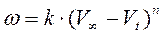
Его линеаризуют: 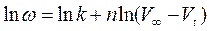
и в результате обработки массива 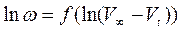 находят формально-кинетические параметры.
находят формально-кинетические параметры.
С целью уточнения найденной константы скорости ДКУ
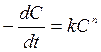
интегрируют для найденного порядка реакции. При большом избытке воды скорость гидролиза зависит только от концентрации эфира, т.е. организованная таким путем реакция (вообще говоря, реакция второго порядка) в этих условиях протекает как реакция первого порядка (т. наз. реакция псевдопервого порядка). (А какой порядок реакции получился у Вас?) Интегрирование дает:
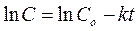
Или: 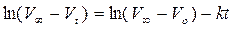
Обработка массива 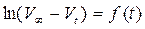 дает из коэффициента регрессии уточненную константу скорости.
дает из коэффициента регрессии уточненную константу скорости.
Применение метода линейной регрессии позволяет из полученных опытных данных рассчитать не только константу скорости k, но и погрешность ее определения и коэффициент корреляции r, дающий возможность оценить правомерность описания процесса кинетическим уравнением первого порядка.
Последовательность выполнения работы
В колбу емкостью 250 мл с притертой пробкой наливают 100 мл раствора 0,5 М HCl. В колбу вводят 5 мл эфира, смесь перемешивают и тотчас отбирают сухой пипеткой пробу 5-10 мл. Момент вливания считается за начало реакции. Колбу с оставшейся смесью закрывают, а взятую пробу незамедлительно вливают в колбу для титрования с 40-50 мл дистиллированной воды («замораживание» состояния пробы) и титруют 0,5 М раствором щелочи по фенолфталеину. Титрование считается оконченным, если розовая окраска держится в течение 20 с. В ходе реакции отбирают 6 проб объемом 5-10 мл через определенные промежутки времени от начала реакции: 10, 20, 30, 60, 90, 120 мин. Каждую пробу титруют 0,5 М раствором щелочи, как описано выше.
Оставшуюся смесь нагревают в течение 30 мин. в колбе с обратным холодильником на водяной бане при t = 70-80°С для доведения реакции до конца и определения V∞. Результаты измерений занести в таблицу:
Результаты изучения скорости гидролиза эфира в кислой среде
| № | t, мин. | Vt , мл | 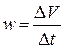
| lnw | ( V∞ – Vt ), мл | ln( V∞ – Vt ) |
| 1 | 0 | |||||
| 2 | 5 | |||||
| 3 | 10 | |||||
| 4 | 15 | |||||
| 5 | 20 | |||||
| 6 | 25 | |||||
| 7 | 30 | |||||
| 8 | 45 | |||||
| 9 | 60 | |||||
| 10 | 75 | |||||
| 11 | 90 | |||||
| 12 | 105 | |||||
| 13 | 120 |
Обработку проводят по программе Линия, как описано выше.
Контрольные вопросы
1. Что такое скорость химической реакции? Запишите выражения для истинной и средней скорости реакции, поясните их.
2. От каких основных факторов зависит скорость реакции?
3. Сформулируйте и запишите закон действующих масс для гомогенных и гетерогенных процессов. Приведите примеры.
4. В чем сущность основного закона (постулат) химической кинетики? Запишите его.
5. Что такое порядок реакции? Каким он может быть и от чего зависит его значение?
6. Что такое константа скорости, в чем ее физический смысл? Почему константу скорости используют как основную кинетическую характеристику?
7. Как влияет температура на скорость процесса и почему? Дайте определение температурного коэффициента.
8. Дайте определение катализатора и каталитического процесса. В чем основная причина ускоряющего действия катализатора?
9. Напишите математические выражения закона действующих масс для следующих реакций:
2SО2 + О2 = 2SО3;
2А + 3В = А2В3;
N2O4 = 2NO2.
10. Во сколько раз изменится скорость реакции 2NO + О2 = 2NО2 при увеличении концентрации NO и O2 соответственно в 2 и 3 раза?
11. Во сколько раз изменится скорость реакции, температурный коэффициент которой равен 2, при повышении температуры на 120°С?
Лабораторная работа № 3








