Опыт 2. Влияние температуры на скорость гомогенной химической реакции
В четыре стакана емкостью 100 мл налить по 20 мл раствора сульфита натрия, а в четыре других – по 2,5 мл раствора иодата калия и по 17,5 мл дистиллированной воды (см. опыт 1).
Одну пару разных стаканчиков термостатировать в течение нескольких минут в кристаллизаторе с водой (температуру контролировать термометрами). После этого растворы слить друг с другом и отметить по секундомеру время появления окраски. Аналогично провести опыты еще при трех температурах. Вычислить для каждой температуры относительную среднюю скорость реакции (см. опыт 1) и построить график ее зависимости от температуры. По программе Линия вычислить температурный коэффициент скорости реакции. Согласуется ли результат с правилом Вант-Гоффа? По той же программе оценить аррениусовы параметры температурной зависимости скорости реакции. Сделать общий вывод.
Опыт 3. Влияние величины поверхности на скорость
гомогенной химической реакции
В две пробирки поместить равные по массе (не более 0,3 г) образцы мела: в одну пробирку порошок, в другую – кусочек. В обе пробирки одновременно влить по 1-2 мл 2 н соляной кислоты. Сравнить скорость растворения мела в обеих пробирках. Написать уравнение реакции.
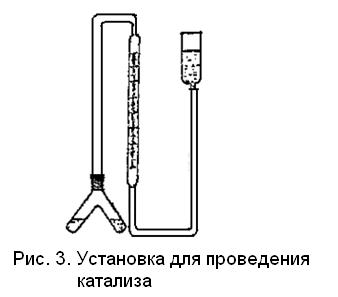 Опыт 4. Гомогенный катализ
Опыт 4. Гомогенный катализ
Собрать прибор (рис. 3). Бюретку заполнить водой. В одно колено двухколенной пробирки через воронку налить точно отмеренные пипеткой 5 мл 3 %-ного раствора пероксида водорода (субстрат), в другое – 1,5 мл 0,1 М раствора дихромата калия (катализатор) и 3 мл дистиллированной воды. Пробирку присоединить к прибору, проверить его герметичность, совместить уровни воды в бюретке и уравнительной трубке и зафиксировать исходный уровень воды.
Смешать растворы субстрата и катализатора. Уравнительную трубку постоянно перемещать вниз, поддерживая в приборе давление, близкое к атмосферному и через каждые 0,5 мин. отмечать объем выделившегося кислорода. Эксперимент заканчивается, когда разница в отсчетах не превысит цены деления бюретки.
Проделать тот же опыт с 3 и 4,5 мл раствора дихромата калия (в первом случае к 3 мл раствора K2Cr2O7 добавить 1,5 мл дистиллированной воды). Как зависит скорость выделения кислорода от концентрации катализатора?
Для реакции
H 2 O 2 = 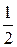 O 2 + H 2 O
O 2 + H 2 O
мера средней скорости w на середине данного временного отрезка пропорциональна приросту объема выделившегося кислорода за данный промежуток времени:
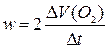
Можно показать, что текущая концентрация субстрата С( H2 O2, t) пропорциональна разности предельного и текущего объемов выделившегося кислорода 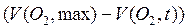 . Поэтому кинетическое уравнение
. Поэтому кинетическое уравнение 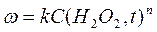 может быть преобразовано к виду:
может быть преобразовано к виду:
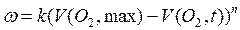
Уравнение линеаризуют:
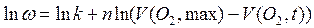
и в результате обработки массива 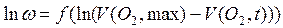 находят формально-кинетические параметры. Константа скорости по существу является мерой активности катализатора. С целью ее уточнения дифференциальное кинетическое уравнение (ДКУ) интегрируют для найденного порядка реакции. Разложение пероксида водорода – реакция первого порядка (а какой порядок реакции получился у Вас?), и интегрирование дает:
находят формально-кинетические параметры. Константа скорости по существу является мерой активности катализатора. С целью ее уточнения дифференциальное кинетическое уравнение (ДКУ) интегрируют для найденного порядка реакции. Разложение пероксида водорода – реакция первого порядка (а какой порядок реакции получился у Вас?), и интегрирование дает:
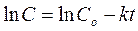
Или:
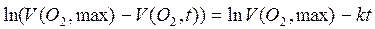
Обработка массива 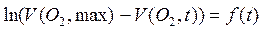 дает из коэффициента регрессии уточненную константу скорости.
дает из коэффициента регрессии уточненную константу скорости.
Применение метода линейной регрессии позволяет из полученных опытных данных рассчитать не только константу скорости k, но и погрешность ее определения и коэффициент корреляции r, дающий возможность оценить правомерность описания процесса кинетическим уравнением первого порядка.








