Опыт 1. Влияние концентрации реагирующих веществ на скорость гомогенной химической реакции
В четыре стакана емкостью 100 мл налить по 20 мл раствора сульфита натрия, подкисленного серной кислотой и содержащего небольшое количество крахмала (1 г соли, 0,95 мл концентрированной серной кислоты и 0,1 г крахмала в 1 л раствора).
В четыре других стаканчика налейте 2.5, 5, 10 и 20 мл раствора иодата калия KJO3 (3,9 г соли в 1 л раствора). В первые три стаканчика с раствором иодата калия добавьте соответственно 17.5, 15 и 10 мл дистиллированной воды, чтобы общий объем раствора составил 20 мл. В четвертый стаканчик воду не добавляйте (см. таблицу). Сливая попарно растворы сульфита натрия и иодата калия, отметьте по секундомеру время появления окраски. Результаты запишите в таблицу:
| Номер стакана | V(Na2SO3), мл | V(KJO3), мл | V(Н2О), мл | С(KJO3)отн. | Время t, с. | wреакции, с–1 |
| 1 | 20 | 2.5 | 17.5 | 1 | ||
| 2 | 20 | 5 | 15 | 2 | ||
| 3 | 20 | 10 | 10 | 4 | ||
| 4 | 20 | 20 | 0 | 8 |
 Построить график зависимости относительной скорости реакции wреакции, равной t–1, от относительной концентрации иодата калия СKIO3. Написать уравнение реакции в молекулярной и сокращенно-ионной формах. Отвечает ли это уравнение механизму протекания реакции? Ответ обосновать.
Построить график зависимости относительной скорости реакции wреакции, равной t–1, от относительной концентрации иодата калия СKIO3. Написать уравнение реакции в молекулярной и сокращенно-ионной формах. Отвечает ли это уравнение механизму протекания реакции? Ответ обосновать.
Вообще исследование кинетики химической реакции начинается с обработки массива преобразованных кинетических данных (w = f ( C )) в плане вычисления формально-кинетических параметров (порядок реакции и константа скорости), на основе чего можно строить предположения о теоретическом механизме реакции.
Для нахождения формально-кинетических параметров удобно организовать исследование так, чтобы можно было фиксировать время достижения какого-либо признака прохождения реакции до определенного состояния в химической системе (например, до появления окраски) в серии (рекомендуется не менее 6-7 точек; чем больше – тем лучше) одинаковых экспериментов (можно принять, что относительная скорость реакции обратна времени появления окраски) при варьировании концентрации только одного из реагентов и постоянстве остальных факторов, включая температуру.
Обработка сводится к оценке параметров (n и k) функциональной зависимости 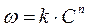 . Поскольку зависимость, в общем случае, нелинейная, а сглаживание по методу наименьших квадратов наиболее удобно проводить для линейной зависимости (программа Линия), то обрабатываемую зависимость линеаризуют:
. Поскольку зависимость, в общем случае, нелинейная, а сглаживание по методу наименьших квадратов наиболее удобно проводить для линейной зависимости (программа Линия), то обрабатываемую зависимость линеаризуют:
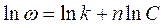
Константа скорости обычно получается с высокой погрешностью (это обычное дело: погрешность вычисления свободного члена, как правило, существенно выше погрешности вычисления регрессионных коэффициентов). Поэтому имеет смысл уточнить константу скорости, после интегрирования (в соответствующих пределах) уравнения:
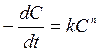
для найденного на предыдущем этапе работы порядка реакции n. Для первого порядка (n=1) (это самый распространенный случай) интегрирование дает:
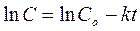
Обрабатывается линейная зависимость 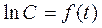 и константа скорости получается равной коэффициенту регрессии с обратным знаком.
и константа скорости получается равной коэффициенту регрессии с обратным знаком.








