Опыт 1 . Определение тепловых эффектов процессов растворения безводной соли и ее кристаллогидрата, вычисление энтальпии гидратации
Приготовьте калориметр к работе. Во внутренний сосуд налейте мерным цилиндром 40 мл дистиллированной воды. На технических весах взвесьте 2-2,5 г вещества (BaCl2, СuSО4, MgSО4, ZnSO4). Проведите термохимические исследования и расчет DТ и DН так, как описано выше.
Проделайте то же с эквимолярным количеством соответствующего кристаллогидрата. Рассчитайте по закону Гесса энтальпию гидратации соли. Сопоставьте найденную величину с рассчитанной из табличных данных по интегральным теплотам растворения, а также по стандартным энтальпиям образования веществ.
Вычислите абсолютную и относительную ошибку опыта.
Опыт 2. Определение теплоты реакции нейтрализации
В сухой внутренний сосуд калориметра налейте 25 мл 1 М раствора гидроксида калия или натрия. Опустите в раствор щелочи термометр (не касаясь дна сосуда) и измеряйте температуру с точностью до 0,1° в течение нескольких минут (начальный период).
К щелочи через воронку прилейте 25 мл 1 М раствора соляной кислоты (начинается главный период) и измеряйте температуру каждые 15-30 секунд до начала ее снижения (начинается конечный период). Эксперимент проводится по схеме, изложенной выше. В конечном периоде температуру измеряйте несколько минут. Время в таблице и на графике сквозное, без обнуления.
Определив DТ по графику (рис. 2), сделайте следующие расчеты.
Определите количество теплоты, выделившееся при нейтрализации 25 мл 1 М соляной кислоты щелочью, приняв плотности растворов равными единице, а теплоемкость – равной теплоемкости воды, т.е. 4,184 Дж/г·К.
Вычисленная таким образом теплота относится к реакции нейтрализации 0,025 моль кислоты. Сделайте пересчет на 1 моль кислоты и щелочи и сравните полученное значение с мольной теплотой нейтрализации, рассчитанной из табличных данных по стандартным энтальпиям образования. Учтите, что Q и DН имеют противоположные знаки.
Определите относительную ошибку опыта.
Контрольные вопросы
1. Что такое тепловой эффект реакции?
2. Что такое энтальпия процесса? Какова взаимосвязь энтальпии и теплового эффекта?
3. Сформулируйте закон Гесса.
4. Что называется теплотой образования химического соединения? Как вычисляется тепловой эффект реакции по теплотам образования веществ, участвующих в реакции?
5. Вычислить энтальпию реакции РСl3 + Сl2 = РСl5, если известны энтальпии образования РСl3 и РСl5, которые соответственно равны –317,6 и –454,8 кДж/моль.
6. Реакция горения фосфина выражается уравнением:
2РН3 + 4О2 = Р2O5 + 3Н2О – 2349,7 кДж.
Вычислить энтальпию образования РН3, если известно, что
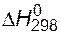 (Р2О5) = -1506,2 кДж/моль;
(Р2О5) = -1506,2 кДж/моль; 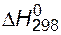 (Н2О) = –285,9 кДж/моль.
(Н2О) = –285,9 кДж/моль.
7. Что такое теплота гидратации?
8. Теплота растворения какой соли больше: СuSO4 или СuSO4·5Н2О? Ответ мотивируйте.
Лабораторная работа № 2








