Окислительно – восстановительные реакции
Уравнять методом полуреакций
1. Au + HNO3(конц) + HCl(конц) ® H[AuCl4] + NO2 + …
2. KMnO4 + HCl(конц) ® Cl2 + MnCl2 + …
3. Ca3P2(тв) + H2SO4(конц) ® CaSO4 + SO2 + H3PO4 + …
4. Re2S7(тв) + HNO3(конц) ® HReO4 + NO2 + H2SO4 + …
5. Si + HNO3 + HF ® H2[SiF6] + NO +…
6. Cu2S(т) + HNO3 ® Cu2+ + SO42- + NO +…
7. R – CОН + [Ag(NH3)2]OH ® R – CООNH4 + Ag¯ + NH3 + …
8. C6H5 – CH3 + KMnO4 ® C6H5 – CООН + MnO2¯ + …
9. C6H5 – CH2 – CH3 + KMnO4 ® C6H5 – CООН + K2CO3 + MnO2¯ + …
10. C2H4 + KMnO4 ® C2H4(OH)2 + MnO2¯ + KOH + …
11. C6H5 – CH2 – CH3 + K2Cr2O7 + H2SO4 ® C6H5 – CООН + CO2+Cr2(SO4)3+ …
12. C12H22O11 + KMnO4 + H2SO4 ® CO2 + MnSO4 + …
Химическое равновесие. Константа равновесия.
Уравнение изотермы химической реакции
Формулы, используемые для расчетов:
aA + bB ↔ cC + dD
ΔG = ΔG° + RTln 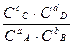 ; ΔG° = – RTlnKc; Kc =
; ΔG° = – RTlnKc; Kc = 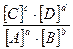
1. Не производя вычислений, установите знак ΔS реакции: 4НСl(г) + О2(г) → 2Н2О(ж) + 2Сl2. (Для этой реакции ΔH<0). Как изменяется константа равновесия с увеличением температуры? При некоторой температуре для экзотермической реакции:N2(г) + 3Н2(г) → 2NH3(г), Кс=6.8.
2. Как изменится величина Кс: а) с увеличением концентрации NH3 в 2 раза, б) с уменьшением температуры?
3. При некоторой температуре для реакции: А + В 1 С - Q, Кс = 4. Как изменится величина Кс:
4. а) с увеличением концентрации вещества В в 10раза, б) с повышением температуры?
5. При некоторой температуре для реакции: 2А + В 1 А2В + Q, Кс = 0.5. Как изменится величина Кс: а) с увеличением концентрации А в 4 раза, б) с уменьшением температуры?
6. Равновесие в системе: 2SO2(г) + О2(г) 1 2SO3(г) установилось, когда 60% SО2 вступило в реакцию. Определите константу равновесия, если исходные концентрации SО2, О2 и SO3 были 3, 2 и 0 моль/дм3.
7. В состоянии равновесия Н2 + I2 1 2НI равновесные концентрации Н2, I2 и НI равны, соответственно, 0.25, 0.05 и 0.2 (моль/дм3). Рассчитайте исходные концентрации I2 и Н2, если исходная концентрация НI равна 0.
8. Как можно сместить равновесие в системе, не изменяя константы равновесия? Приведите примеры.
9. Назовите факторы, позволяющие смещать химическое равновесие в сторону большего выхода продукта реакции в системе; СН3СНО(Г) + 0.5О2(г) ) 1 СН3СООН(ж), ΔH0 = -319 кДж; а) изменяющие константу равновесия, б) не изменяющие константу равновесия.
10. Назовите факторы, позволяющие смещать химическое равновесие в сторону большего выхода продукта реакции в системе: СН3СООН(ж) + С2Н5ОН(ж) 1 СН3СООС2Н5(ж) + Н2О(ж), ΔH0 = 7 кДж, а) изменяющие константу равновесия, б) не изменяющие константу равновесия.
11. Назовите факторы, позволяющие смещать химическое равновесие в сторону большего выхода продукта реакции в системе: 2СО(г) + 2Н2(г) 1 СН4(г) + СО2(г), ΔH0 = -358 кДж; а) изменяющие константу равновесия, б) не изменяющие константу равновесия.
12. Назовите факторы, позволяющие смещать химическое равновесие в сторону большего выхода продукта реакции в системе: N2 + О2 1 2NO(г), ΔH0 = 181 кДж; а) изменяющие константу равновесия, 6) не изменяющие константу равновесия.
13. Экспериментально установлено, что при повышении температуры увеличивается степень превращения иодоводорода в Н2 и I2. Какой является эта реакция - экзотермической или эндотермической? Ответ поясните. Запишите выражение для константы этого равновесия.
14. С ростом температуры равновесие реакции: СО(г) + 2Н2(г) 1 СН3ОН(г), сдвигается в сторону прямой реакции. Сделайте вывод о знаке ΔH реакции. Как изменится константа равновесия реакции, если концентрацию СО увеличить в 4 раза?
15. С ростом температуры равновесие в системе: 2SO2(г) + О2(г) 1 2СО(г) смещается влево. Сделайте вывод о знаке теплового эффекта реакции.
16. С ростом температуры равновесие в системе: СН3СНО(ж) + 0.5О2(г) 1 СН3СООН(ж) смещается влево. Сделайте вывод о знаке теплового эффекта реакции.
17. С ростом температуры равновесие в системе С(т) + СО2(г) 1 2СО(г) смещается вправо. Сделайте вывод о знаке теплового эффекта реакции.
18. С ростом температуры равновесие в системе: С2Н5ОН(ж) 1 С2Н4(г) + Н2О(ж) смещается вправо. Сделайте вывод о знаке теплового эффекта реакции.
19. Для трех температур известны значения констант равновесия реакции:
Н2(г) + Сl2(г) 1 2Сl(г): Кс(300 К) = 3.2.·1016; Кс(600 К) = 2.5·108 Кс(900 К) = 5.5·105. Исходя из представленных данных, определите знак изменения энтальпии реакции в этом интервале температур и запишите выражение для константы равновесия.
20. Для трех температур известны значения ионного произведения воды: Кw(273 К) = 1.1·10-16, Кw(298 К) = 10-14, Кw(323 К) = 5.5·10-14. Исходя из представленных данных, определите знак изменения энтальпии реакции диссоциации воды в этом интервале температур и запишите выражение для константы равновесия.
21. Как повлияет на сдвиг равновесия реакции: SO2(г) + NO2(г) 1 SO3(г) + NO(г), а) увеличение давления, б) увеличение концентрации NО? Запишите выражение для константы равновесия.
22. Как повлияет на состояние равновесия системы: СН4(г) + Н2О(г) 1 СО(г) + 3Н2(г), а) понижение давления; б) увеличение концентрации Н2? Запишите выражение константы равновесия.
23. Как повлияет на состояние равновесия системы: NO(г) + NO2(г) 1 N2O3(г), ΔH0298<0, а) понижение давления; ,б) увеличение температуры? Запишите выражение константы равновесия.
24. Как повлияет на состояние равновесия системы: 2NO2(г) 1 2NO(г) + О2(г), ΔH0298>0; а) понижение давления б) увеличение температуры? Запишите выражение константы равновесия.
25. Для следующих обратимых реакций запишите выражения констант химического равновесия (Кс) и определите, как повлияет 1) понижение давления и 2) повышение температуры на состояние равновесия этих систем;
а) H2S(г) 1 Н2(г) + S(тв), ΔH0298 = 21 кДж;
б) СО(г) + 2Н2(г) 1 СН3ОН(г), ΔH0298 = -90кДж.
26. Для следующих обратимых реакций запишите выражения констант химического равновесия (Кс) и определите, как повлияет 1) понижение давления и 2) повышение температуры на состояние равновесия этих систем:
а) 4НСl(г) + О2(г) 1 2Н2О(г) + 2Сl2(г), ΔH0298 = -114 кДж;
б) 2НВ(г) 1 Н2(г) + Вг2(г), ΔH0298 = 72 кДж.
27. Для следующих обратимых реакций запишите выражения констант химического равновесия (Кс) и определите, как повлияет 1) повышение давления и 2) понижение температуры на состояние равновесия этих систем:
а) 3О2(г) 1 2О3 ΔH0298 = 285 кДж;
б) 3Fe(тв) + 4Н2О 1 Fe3O4(тв) + 4Н2 ΔH0298 = -150 кДж
28. Для следующих обратимых реакций запишите выражения констан - химического равновесия (Кс) и определите, как повлияет 1)повышение давления и 2) понижение температуры на состояние равновесия этих систем:
а) СО(г) + Н2О(г) 1 СО2(г) + Н2(г) ΔH0298 = -41 кДж;
б) N2(г) + О2(г) 1 2NO(г), ΔH0298 = 180кДж.
29. Для следующих обратимых реакций напишите выражения констант химического равновесия (Кс) и определите, как повлияет 1)понижение давления и 2) повышение температуры на состояние равновесия этих систем:
а) 2SО2(г) + О2(г) 1 2SО3(г), ΔH0298 = -196 кДж;
б) 2СО(г) 1 СО2(г) + С(тв) ΔH0298 = -172кДж.
30. Для следующих обратимых реакций запишите выражения констант химического равновесия (Кс) и определите, как повлияет 1) понижение давления и 2) повышение температуры на состояние равновесия зтих систем:
а) СОСl2(г) 1 СО(г) + Сl2(г), ΔH0298 = 112 кДж;
б) N2O4(г) 1 2NO2(г) ΔH0298 = 58 кДж.
31. Для следующих обратимых реакций запишите выражения констант химического равновесия (Кс) и определите, как повлияет 1) повышение давления и 2) понижение температуры на состояние равновесия этих систем:
а) 4NН3(г) + 5О2(г) 1 4NО(г) + 6Н2О(г), ΔH0298 = -908 кДж;
б) Н+(р) + ОН-(р) 1 Н2О(ж), ΔH0298 = -55 кДж.
32. Для следующих обратимых реакций запишите выражения констант химического равновесия (Кс) и определите, как повлияет 1) повышение давления и 2) понижение температуры на состояние равновесия этих систем:
а) СаСО3(тв) 1 СаО(тв) + СО2(г), ΔH0298 = 177 кДж;
б) СН4(г) 1 С(тв) + 2Н2(г) ΔH0298 = 75 кДж.
33. Какие из перечисленных факторов будут смещать равновесие реакции: N2(г) + 3Н2(г) 1 2NH3(г); ΔH0 = -92 кДж, в сторону образования NH3 а) понижение температуры; б) увеличение объема; в) увеличение давления; г) введение катализатора?
34. Какие из перечисленных факторов будут смещать равновесие реакции: 2СО(г) + О2(г) 1 2 СО2(г); ΔH0 = -566 кДж, в сторону образования СО2 а) понижение температуры; б) увеличение объема; в) увеличение давления; г) введение катализатора?
35. Какие из перечисленных факторов будут смещать равновесие реакции:
2NО(г) + О2(г) 1 2NO2(г); ΔH0 = -113 кДж, в сторону образования NО2 а) понижение температуры; б) увеличение объема; в) увеличение давления; г) введение катализатора?
36. Какие из перечисленных факторов будут смещать равновесие реакции:
2С12(г) + 2Н2О(г) 1 4НСl(г) + О2(г) ΔH0 = +115 кДж, в сторону образования НС1 а) понижение температуры; б) увеличение объема; в) увеличение давления; г) введение катализатора?








