Экспериментальная проверка правила Шульце-Гарди
Цель работы : Экспериментальная проверка выполнения правила Шульце-Гарди при коагуляции золей электролитами с заданной их концентрацией.
В результате выполнения данной работы студент должен:
– знать способы классификации дисперсных систем;
– знать условия получения гидрофобных золей малорастворимых веществ методом химической конденсации;
– знать правила составления формул мицеллы золя, охарактеризовать ее структурные элементы;
– знать виды и факторы устойчивости гидрофобных золей;
– знать методы коагуляции и стабилизации дисперсной фазы;
– знать правило Шульце-Гарди, Дерягина и Ландау, уметь их использовать при оценке коагулирующей способности различных коагулянтов.
Оборудование и реактивы : Пробирки, пипетка (10 см3), груша резиновая, золи Fe(OH)3(+), KFe[Fe(CN)6]–; коагулирующие ионы NaCl (4М), NaCl (0,08М), Na2SO4 (0,08М), BaCl2 (0,08М).
Последовательность выполнения работы:
1. Записать формулы золя Fe(OH)3(+) полученного в результате реакции гидролиза FeСl3 и золя KFe[Fe(CN)6], полученного в результате реакции хлорида железа (III) с гексацианоферратом (II) калия. Заполнить теоретическую таблицу 14.
Таблица 14 – Коагулирующее действие электролитов (на основании теоретических расчетов).
| Золь | Заряд золя | Коагулирующий ион и его концентрация | |||
| NaCl (4М) | NaCl (0,08М) | Na2SO4 (0,08М) | BaCl2 (0,08М) | ||
| Fe(OH)3 , оранжевый | |||||
| К Fe[Fe(CN)6] , синий | |||||
2. На основе эксперимента требуется установить, который из данных растворов будет вызывать коагуляцию при добавлении в золь, как изменяется коагулирующая способность электролитов в зависимости от их природы и концентрации.
Для этого в каждую из двух групп пробирок (по 4 пробирки в каждой группе), содержащих по 5 см3 раствора с коагулирующими ионами (пробирки соответственно пронумерованы), приливают по 5 см3 золя Fe(OH)3 (оранжевое окрашивание) – первая группа пробирок и по 5 см3 золя КFe[Fe(CN)6] (синее окрашивание) – вторая группа пробирок. Хорошо перемешивают и наблюдают, в какой пробирке произойдет коагуляция золей электролитами. По результатам наблюдений составляют таблицу 15 (на основании экспериметальных исследований), в которой знаком «+» обозначают ионы, вызывающие коагуляцию, знаком «–» – нет.
Примечание – все вычисления выполнить в рабочей тетради сделать выводы по проделанной работе.
Вопросы и задачи для самостоятельного решения
1. Какие системы называют коллоидными? Назовите две основные группы методов получения коллоидных растворов, сформулируйте их сущность.
2. Напишите формулу мицеллы золя йодида серебра, полученного добавлением 40 см3 0,02 М раствора AgNO3 к 50 см3 0,001 М раствора КI. Каким методом получен золь?
3. Какое явление называется коагуляцией? Факторы, вызывающие коагуляцию лиофобных золей.
4. Что называется порогом коагуляции? В каких единицах выражается эта величина?
5. Коагуляция 10 см3 гидрозоля гидроксида железа (III) наступила при добавлении к нему 2 см3 раствора Na2SO4 с молярной концентрацией 0,0025 моль/дм3. Вычислить порог коагуляции и коагулирующую способность электролита.
6. Определите знак заряда коллоидных частиц золя, если при его коагуляции электролитами получены следующие пороги коагуляции (моль/дм3): cп(KNO3) = 300; cп (MgCl2) =320; cп (Na3PO4) = 0,6.
7. Какое явление называют солюбилизацией? Приведите примеры.
Решение задач приложить к отчету.
Лабораторная работа № 10.
Экстракция. Определение коэффициента распределения йода между двумя жидкими несмешивающимися фазами .
Экстракцией (русский синоним – вытяжка) называется процесс извлечения растворенного вещества из раствора с помощью второго растворителя (экстрагента), который практически не смешивается с первым и лучше растворяет извлекаемое вещество. Очень часто первым растворителем (I фаза) является вода, а вторым (II фаза) – один из органических растворителей, который не смешиваются с водой: тетрахлорметан CСl4, хлороформ СНСl3, бензол С6Н6, толуол С6Н5–СН3, гексан С6Н14, диэтиловый эфир С2Н5–О–С2Н5 и т. д.
Если водный раствор, содержащий извлекаемое вещество А, привести в контакт с органическим растворителем (экстрагентом) и полученную систему интенсивно взболтать, то образуется эмульсия (мелкие капли) органического растворителя в воде – площадь контакта между фазами резко возрастает и растворенное вещество А частично переходит из водного раствора в органическую фазу. Важно помнить, что межфазную границу может пересекать лишь та форма растворенного вещества, которая может одновременно существовать в обеих контактирующих фазах. Например, если между фазами перераспределяется уксусная кислота, то в водной фазе она частично диссоциирует и существует здесь в двух формах – недиссоциированной и ионной, а в неполярной органической фазе кислота не диссоциирует, но часть молекул кислоты образует димеры за счет водородных связей между карбоксильными группами двух молекул и, таким образом, она тоже существует в двух формах – мономера и димера. Очевидно, что межфазную границу может пересекать только недиссоциированная форма уксусной кислоты со стороны водной фазы и мономер со стороны органической фазы.
Через некоторое время после окончания перемешивания смесь расслоится и образуется две фазы, содержащие растворенное вещества А: водная (ее называют рафинат) и органическая (ее называют экстракт), а относительно той формы вещества А, которая может пересекать межфазную границу, устанавливается экстракционное равновесие:
А (водная фаза – рафинат) ↔ А (органическая фаза – экстракт)
Это равновесие характеризуется константой распределения К, которая связывает равновесные молярные или массовые концентрации распределяемой формы вещества А в экстракте и рафинате:
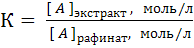 =
= 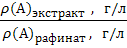 (1)
(1)
причем константа К зависит от природы системы и температуры, но не зависит от концентрации вещества А в исходном водном растворе (закон распределения Нернста).
Если растворенное вещество А может находиться в контактирующих фазах в нескольких формах, то обычно в опыте определяют равновесную суммарную (общую) или брутто–концентрацию вещества А в каждой из фаз с учетом всех форм его существования в данной фазе. Подобные ситуации возникают, когда молекулы А участвуют в побочных реакциях, например, диссоциации, ассоциации или комплексообразования. Отношение равновесных брутто–концентраций вещества А в контактирующих фазах называют коэффициентом распределения D :
D = 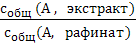 =
= 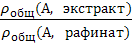 (2)
(2)
Если вернуться к упомянутому выше примеру распределения уксусной кислоты между водной и органической фазами, где молекулы кислоты участвуют в побочных процессах диссоциации (водная фаза) и димеризации (органическая фаза), то
собщ (СН3СООН/ рафинат) = [СН3СООН] + [СН3СОО– ] и
собщ (СН3СООН/ экстракт) = [СН3СООН] + 2 [ (СН3СООН)2 ].
Важно помнить, что в общем случае коэффициент распределения D уже зависит не только от природы системы и температуры. но и от начальной концентрации А в водной фазе и условий проведения экстракции. В простейшем частном случае, когда вещество А не участвует в побочных процессах и существует в контактирующих фазах в одинаковой форме, коэффициент распределения D совпадает с константой распределения К и при любых начальных концентрациях А в водной фазе остается величиной постоянной. Последний факт можно рассматривать как экспериментальное доказательство отсутствия осложняющих экстракцию побочных химических процессов.
Экстракцию проводят в делительных воронках (рисунок 10), позволяющих разделить экстракт и рафинат после установления экстракционного равновесия и полного расслоения жидкостей. Если плотность органического растворителя меньше плотности воды (1,000 г/см3), то экстракт образует верхний слой в делительной воронке; если наоборот – нижний (плотности органических растворителей (20 0С) : тетрахлорметан CСl4 – 1,594 г/см3 , хлороформ СНСl3 – 1,489 г/см3, бензол С6Н6 – 0,879 г/см3, толуол С6Н5–СН3 – 0,867 г/см3, гексан С6Н14 – 0,6595 г/см3, диэтиловый эфир С2Н5–О–С2Н5 – 0,7135 г/см3).
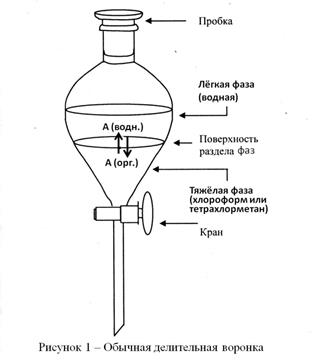 При известных коэффициенте распределения и начальном содержании извлекаемого вещества А в водном растворе расчет результатов экстракции проводят следующим образом. В делительную воронку вносят водный раствор объемом Vв , содержащий m0 г извлекаемого вещества А, далее в воронку добавляют экстрагент объемом Vэ и смесь интенсивно встряхивают в течение 5 – 10 минут до установления экстракционного равновесия. После окончания перемешивания и полного расслоения жидкостей объемы рафината и экстракта равны исходным объемам Vв и Vэ соответственно, поскольку растворители не смешиваются. Пусть в рафинате осталось m1 г вещества А, тогда в экстракт перешло (m0 – m1) г, а равновесные массовые концентрации А в них равны:
При известных коэффициенте распределения и начальном содержании извлекаемого вещества А в водном растворе расчет результатов экстракции проводят следующим образом. В делительную воронку вносят водный раствор объемом Vв , содержащий m0 г извлекаемого вещества А, далее в воронку добавляют экстрагент объемом Vэ и смесь интенсивно встряхивают в течение 5 – 10 минут до установления экстракционного равновесия. После окончания перемешивания и полного расслоения жидкостей объемы рафината и экстракта равны исходным объемам Vв и Vэ соответственно, поскольку растворители не смешиваются. Пусть в рафинате осталось m1 г вещества А, тогда в экстракт перешло (m0 – m1) г, а равновесные массовые концентрации А в них равны:
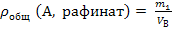 ;
; 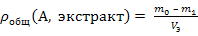 .
.
Подставляя эти выражения в (2), после простых преобразований можно получить соотношение:
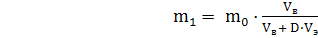 (3)
(3)
Эффективность экстракции характеризуют степенью извлечения вещества А, сравнивая его количество (массу) в экстракте с начальным количеством (массой) в исходном водном растворе:
R, % = 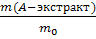 ∙100% =
∙100% = 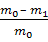 · 100 %
· 100 %
Последний показатель при данных объемах исходного водного раствора Vв и экстрагента Vэ можно улучшить, если несколько изменить процедуру проведения эксперимента, применив так называемую периодическую или дробную экстракцию. С этой целью доступный объем экстрагента Vэ делят на n равных порций и далее исходный раствор А обрабатывают n раз порциями свежего экстрагента объемом (V э / n) по указанной выше методике, отделяя каждый раз экстракт от рафината. После подобного экстрагирования в конечном рафинате остаток вещества А составляет:
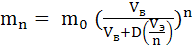 (4)
(4)
а в объединенном экстракте объемом Vэ масса А равна (m0 – mn) г.
Поскольку mn < m1 , то, очевидно, Rn > R и чем больше число последовательных стадий экстрагирования, тем выше полнота (эффективность) извлечения А при одном и том же общем объеме взятого экстрагента.
Цель работы : определить коэффициент распределения йода между водной и органической (СНСl3 или ССl4) фазами на основе анализа исходного водного раствора йода и рафината методом йодометрии.
Последовательность выполнения работы:
1. В мерной колбе вместимостью 100 см3 получить задачу – некоторый объем окрашенного водного раствора йода, разбавить его дистиллированной водой до метки и тщательно перемешать.
2. Разбавленный раствор йода перелить из мерной колбы в стакан. С помощью пипетки отобрать 50,0 см3 этого раствора и перенести его в делительную воронку вместимостью 100 см3, добавить из бюретки 10,0 см3 экстрагента, закрыть воронку пробкой и интенсивно встряхивать в течение 5 – 10 минут. По окончании экстрагирования закрепить воронку на штативе с помощью лапки и оставить систему до полного расслаивания, при этом интенсивность окраски водного раствора (верхний слой) снижается , а экстракт (нижний слой) приобретет фиолетовый цвет.
3. Определить молярную концентрацию йода в разбавленном растворе методом иодометрии. В основе химического анализа лежит окислительно – восстановительная реакция между йодом (окислитель) и тиосульфатом натрия Na2S2O3 (восстановитель):
| J2 | + | 2 Na2S2O3 | ® | 2 NaJ | + | Na2S4O6 |
| тиосульфат натрия | тетратионат натрия |
Полуреакции и эквиваленты реагентов:
| J2 + 2e ® 2J– | Þ | Э(J2) = 1/2J2 |
| 2S2O32– - 2e ® S4O62– | Þ | Э(Na2S2O3) = ½( 2 Na2S2O3) = 1/1 Na2S2O3, |
а закон эквивалентов имеет вид:
n (1/2J2) = n (1/1Na2S2O3).
В качестве индикатора используют свежеприготовленный водный раствор крахмала, который в присутствии йода окрашивает раствор в синий цвет. Индикатор добавляют в исследуемый раствор йода в конце титрования, когда он приобретет светло–желтый цвет, и титрование продолжают до полного обесцвечивания раствора от одной избыточной капли титранта.
В колбу для титрования вместимостью 100 см3 отобрать пипеткой 10,0 см3 анализируемого раствора, заполнить бюретку стандартным раствором тиосульфата натрия с(1/1 Na2S2O3) = 0,01 моль/дм3 и титровать бурый раствор иода до светло-желтого цвета, затем добавить 10 капель раствора крахмала – титруемый раствор приобретет синюю окраску, продолжить титрование до полного обесцвечивания раствора. Титрование повторяют три раза, допустимый разброс в параллельных титрованиях ± 0,1 см3. Находят среднее значение Vт и рассчитывают молярную концентрацию эквивалента йода по уравнению :
с0(1/2 I2) = 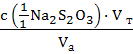 . (5)
. (5)
где Vа и Vт – аликвота исследуемого раствора йода и объем титранта в точке эквивалентности, см3.
Далее вычислить молярную концентрацию йода c0 (I2) = 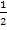 c0 (1/2 I2) и его массовую концентрацию , г/дм3:
c0 (1/2 I2) и его массовую концентрацию , г/дм3:
ρ0 (I2) = c0 (1/2 I2) · М(1/2 I2) = c0 (I2) · М(I2) (6)
4. В делительной воронке отделить экстракт от рафината – слить нижний слой (экстракт – 10 см3) в стакан и перенести его в бутыль для сбора органических отходов. Оставшийся в воронке рафинат (50 см3) слить в другой стакан и выполнить анализ рафината и все расчеты согласно пункту 3.
5. Рассчитать коэффициент распределения D йода между водой и органическим растворителем. Равновесную массовую концентрацию йода в рафинате взять из пункта 4, а равновесную массовая концентрация йода в экстракте вычислить по формуле:
ρ (I2 / экстракт) = 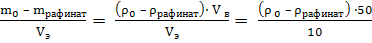 .
.
Найденные величины подставить в определение (2).
6. Рассчитать степень извлечения йода:
R, % = 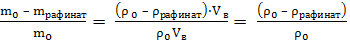 · 100 %
· 100 %
7. Экспериментальные и расчетные результаты занести в таблицу 16.
Таблица 1 6 – Результаты йодометрического определения коэффициента распределения йода между органической и водной фазами (объем рафината – 50,0 см3, объем экстрагента (…..) – 10,0 см3; титрант с(1/1 Na2S2O3)=0,01 моль/л, индикатор – крахмал, V ал. = 10,0 см3)
| Объем титранта Vт ,см3 | с(1/2J2), моль/дм3 | с(J2), моль/дм3 | ρ(J2), г/ дм3 | ρ(J2), (экстракт), г/ дм3 | Коэффициент распределения, D | Степень извлечения R, % | |
| Исх. раствор йода | …. …. …. Vср. = |
|
|
| |||
| Рафинат | …. …. …. Vср. = |
8. Дополнительные задания:
а) сравнить полученный Вами коэффициент распределения D с результатами коллег по группе и сделать вывод о форме существования йода в сопряженных фазах и свойстве этой величины;
б) по формуле (4) вычислить результат экстракции, если ее проводить половинными объемами экстрагента 5,0 см3, и соответствующую величину степени извлечения R2, используя для расчета найденное значение D; сравнить эффективность однократной и дробной (n = 2) экстракции при одном и том же объеме использованного экстрагента Vэ = 10,0 см3.
Задачи для самостоятельного решения.
1. Коэффициент распределения йода между CCl4 и водой равен 85,47 при 298 К. В обоих растворителях йод имеет одинаковую молярную массу. Какой объем CCl4 следует взять, чтобы однократным экстрагированием извлечь из 0,5 дм3 водного раствора 90 % содержащегося в нем йода. Во сколько раз уменьшится остаток йода в рафинате, если проводить двукратное экстрагирование половинными порциями найденного объема органического растворителя.
(Ответ: 52,5 см3; в три раза)
2. При 298 К раствор фенола в амиловом спирте с массовой концентрацией фенола 10,53 г/дм3 находится в равновесии с его водным раствором, имеющим массовую концентрацию фенола 0,658 г/дм3. Определить массу фенола, которую можно извлечь двукратным экстрагированием порциями по 0,1 дм3 амилового спирта из 0,5 дм3 водного раствора с массовой концентрацией фенола 37, 6 г/дм3, и степень его извлечения.
(Ответ: 17,734 г ; 94,3%)
3. Сравнивая остаток вещества А в рафинате, докажите в общем виде, что двукратная экстракция половинными объемами экстрагента более эффективна, чем однократная всем объемом.
4 Природный уран в основном состоит из изотопа 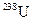 (99,3 %). В ядерной реакции на атомных электростанциях участвует только изотоп
(99,3 %). В ядерной реакции на атомных электростанциях участвует только изотоп 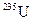 , содержание которого в природном уране составляет примерно 0,7 %. В обогащённом уране содержание изотопа
, содержание которого в природном уране составляет примерно 0,7 %. В обогащённом уране содержание изотопа 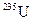 искусственно увеличено до 3 – 20 % или более. Именно обогащённый уран используется как топливо в ядерных реакторах.
искусственно увеличено до 3 – 20 % или более. Именно обогащённый уран используется как топливо в ядерных реакторах.
В водах мирового океана содержится 4,5 миллиарда тонн урана в виде уранил-иона 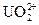 . Это примерно в 820 раз больше, чем можно извлечь из всех известных месторождений урановой руды, из которой этот металл сегодня добывается для использования в ядерных реакторах. Однако в виду низкой концентрации и специфической формы уранил-иона, его экономически выгодное извлечение из морской воды известными химическими методами до недавнего времени считалось практически невозможным.
. Это примерно в 820 раз больше, чем можно извлечь из всех известных месторождений урановой руды, из которой этот металл сегодня добывается для использования в ядерных реакторах. Однако в виду низкой концентрации и специфической формы уранил-иона, его экономически выгодное извлечение из морской воды известными химическими методами до недавнего времени считалось практически невозможным.
В 2010 году американские учёные (по материалам работы S. Beer et al, Chem. Sci., 2010, 1, 43 – 47) предложили использовать для этого 2,6-терфенилкарбоновую кислоту, анион который в слабощелочной среде, например, растворе аммиака, селективно координирует уранил-ион, образуя устойчивый, малорастворимый в воде комплекс. Объёмные фенильные группы закрывают уранил-ион в виде капсулы, таким образом, вытесняя воду из внутренней сферы и усиливая прочность комплекса:
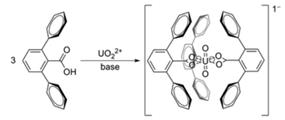
Схема реакции комплексообразования
Полученный комплекс можно экстрагировать из водного раствора хлороформом. Эксперименты показали, что при достижении фазового равновесия концентрация комплекса в органической фазе в 40 раз выше, чем в водной.
3RCOOH(в) + UO22+(в) + 3NH3(в) → NH4[UO2(RCOO)3] (в) + 2NH4+ (в)
NH4[UO2(RCOO)3] (в) ↔ NH4[UO2(RCOO)3] (о)
При обработке органического экстракта разбавленным раствором азотной кислоты происходит реэкстракция комплекса в водную фазу, где в кислой среде он разрушается и тем самым уранил-ион количественно (полностью) переходит в водную фазу.
NH4[UO2(RCOO)3] (о) → NH4[UO2(RCOO)3] (в)
NH4[UO2(RCOO)3](в) + 3H+(в) → 3RCOOH(в) + UO22+(в) + NH4+(в)
После добавления основания к полученному раствору (для нейтрализации избытка азотной кислоты и создания слабощелочной среды) его можно снова экстрагировать с помощью 2,6-терфенилкарбоновой кислоты. Повторяя эту серию процедур несколько раз, можно добиться значительного концентрирования урана в воде.
Вопросы.
I Рассчитайте молярную концентрацию уранил-иона с0 в морской воде, учитывая, что объём вод мирового океана составляет 1,3 млрд. кубических километров.
Рекомендации и ответ: каждая из форм существования урана – уранил-ион и его комплекс содержат один атом урана, поэтому молярная концентрация любой формы равна концентрации самого урана; с0 = 1,45·10–8 моль/л
II Сколько раз необходимо повторить цикл концентрирования исходной морской воды, чтобы достичь концентрации уранил-иона не менее 0,5 моль/л?
При решении используйте следующие данные:
а) при экстракции урана из водной фазы объём органической фазы в 10 раз меньше объёма морской воды;
б) при обратной экстракции урана в водную фазу объём раствора азотной кислоты в 10 раз меньше объёма органической фазы;
в) нейтрализация избытка разбавленной азотной кислоты и создание щелочной среды достигаются пропусканием газообразного аммиака через раствор, при этом увеличением объёма раствора можно пренебречь.
Рекомендации и ответ: для расчета молярной концентрации урана (точнее его комплекса) в экстракте составьте уравнение материального баланса относительно количества урана: уран из объема взятой морской воды распределяется между экстрактом и рафинатом, причем по условию задачи сэкстракт = 40 срафинат ; сэкстракт = 8с0 , а после полной реэкстрации в водную фазу с(UO22+) = 80с0. Следовательно, один цикл концентрирования приводит к 80-кратному увеличению концентрации урана, всего необходимо 4 цикла.
III Потребление урана в мире составляет около 65 тыс. тонн в год. Через сколько лет следует ожидать истощения месторождений урановой руды? Предполагая, что после этого уран будет добываться из океана, и что скорость потребления останется неизменной, оцените количество воды, которое нужно будет перерабатывать в мире ежедневно, чтобы удовлетворить потребность в уране.
Рекомендации и ответ: мировые запасы урана в виде руды 5,49·106 т, их хватит на 84,5 года; ежедневная переработка 51,6 км3 морской воды.
5 В каком соотношении необходимо разделить Vэ мл экстрагента при проведении двукратной последовательной экстракции вещества А из его водного раствора объемом Vв, чтобы степень извлечения вещества А была максимальной? Сформулируйте общее правило достижения максимальной степени извлечения вещества А при проведении его многократной последовательной экстракции из водного раствора объемом Vв при наличии экстрагента объемом Vэ. Запишите расчетную формулу для Rmax.
Рекомендации и ответ: принять, что для последовательной экстракции были взяты объемы V1 = α Vэ и V2 = (1 – α) Vэ , где параметр 0 < α < 1; рассчитать остаток вещества А в рафинате после его двукратной обработки указанными объемами экстрагента; получить выражение для степени извлечения R и продифференцировать его по α, приравняв производную к нулю; αоптимальн. = 0,5 – данный объем экстрагента Vэ нужно разделить пополам.
Приложение: расчетные задачи








