Вопросы и задачи приложить к отчету.
1 1 . Тема 9. Физикохимия дисперсных систем. Классификация дисперсных систем. Лиофобные коллоидные системы (золи), их получение, свойства. Коагуляция золей электролитами. Правило Шульце-Гарди.
Коллоидные растворы (золи) – это гетерогенные системы, обладающие большой свободной энергией поверхности, т.е. они термодинамически неустойчивы. Различают кинетическую и агрегативную устойчивость золей. Кинетическая устойчивость золей обеспечивается броуновским движением частиц дисперсной фазы, которое противодействует оседанию частиц под действием силы тяжести. Причиной агрегативной устойчивости золей является наличие у частиц одноименных зарядов и сольватных оболочек, которые препятствуют слипанию частиц.
Коагуляция золей – процесс объединения коллоидных частиц в более крупные агрегаты вследствие потери агрегативной устойчивости. Процесс коагуляции могут вызвать различные факторы: изменение температуры, механическое воздействие, облучение, добавление растворов электролитов. Наиболее изучена и имеет практическое наибольшее практическое значение коагуляция золей электролитами.
Сильные электролиты вызывают коагуляцию золей, при достижении (электролитов) концентрации их в растворе некоторого значения, называемого порогом коагуляции.
Порог коагуляции (ск) – минимальное количество электролита (в молях), которое надо добавить к 1 дм3 золя, чтобы вызвать начало коагуляции за определенный промежуток времени. Порог коагуляции рассчитывается по формуле:
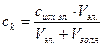 [моль]
[моль]
Коагулирующее действие электролитов подчиняется правилу Шульце-Гарди: коагуляцию вызывают ионы с зарядом, противоположном  заряду гранулы, а коагулирующая способность тем выше, чем выше заряд коагулирующего иона.
заряду гранулы, а коагулирующая способность тем выше, чем выше заряд коагулирующего иона.
Таким образом, лучшим коагулятором является тот электролит, который имеет наименьший порог коагуляции для данного золя.
Дерягин и Ландау с помощью теоретических расчетов показали, что значения порогов коагуляции для коагулирующих ионов различного заряда относятся как ск(+1) : ск(+2) : ск(+3) ~ 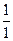 :
: 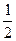 :
: 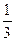 , т.е. коагулирующее действие ионов растет пропорционально обратному значению шестой степени величины заряда иона.
, т.е. коагулирующее действие ионов растет пропорционально обратному значению шестой степени величины заряда иона.
Лабораторная работа №9.








