Комплексонометрическое определение общей жесткости воды
Цель работы: определение общей жесткости воды с использованием стандартного раствора динатриевой соли этилендиаминтетрауксусной кислоты (трилона Б).
В результате выполнения данной работы студент должен:
– знать донорно-акцепторный механизм образования химической связи;
– уметь охарактеризовать состав молекулы комплексного соединения;
– уметь записать уравнения диссоциации комплексного соединения, комплексного иона в водном растворе;
– уметь записать выражение для Кнест (Куст) комплексного иона;
– уметь сравнивать устойчивость комплексных соединений по значениям Кнест (Куст);
– знать виды жесткости воды, способы их определения и устранения;
– знать принцип действия индикатора в методе комплексонометрического титрования.
Оборудование и реактивы: прибор для титрования, стаканы химические различной вместимости, пипетки вместимостью 20; 25; 50 см3, цилиндры мерные колбы, колбы конические для титрования, груша резиновая, воронка для заполнения бюретки, минеральная вода различных производителей (исследуемый раствор), стандартный раствор динатриевой соли этилендиаминтетрауксусной кислоты (трилона Б) с молярной концентрацией эквивалента 0,05 моль/дм3, аммиачный буферный раствор с рН 9,6, индикатор эриохром черный Т (ЭХЧ-Т) – сухая смесь.
6.1 Определение общей жесткости водопроводной воды
Последовательность выполнения работы
1. В колбу для титрования вместимостью 250 см3 с помощью мерного цилиндра переносят 50 см3 водопроводной воды, добавляют 5 см3 аммиачного буферного раствора с рН 9,6 – 10 и далее на кончике шпателя вносят несколько крупинок смеси индикатора. Содержимое колбы тщательно перемешивают до полного растворения индикатора, раствор приобретает винно-красную окраску.
2. Заполняют бюретку стандартным раствором трилона Б, с(1/2 Na2H2Y) = 0,01 моль/дм3 и титруют им исследуемый раствор до резкого изменения окраски от винно-красной к синей от одной избыточной капли титранта. Титрование повторяют три раза, допустимый разброс в параллельных титрованиях ± 0,1 см3. Находят среднее значение Vт и рассчитывают общую жесткость воды по уравнению (9.2).
6.2 Определение временной жесткости водопроводной воды
Последовательность выполнения работы
1. В колбу для титрования вместимостью 250 см3 с помощью мерного цилиндра переносят 50 см3 водопроводной воды, добавляют несколько капель метилоранжа, содержимое колбы тщательно перемешивают, раствор приобретает желтую окраску.
2. Заполняют бюретку стандартным раствором хлороводородной (соляной) кислоты с(1/1 HCl) = 0,01 моль/дм3 и титруют исследуемый раствор до изменения окраски от желтой к оранжево-красной от одной избыточной капли титранта. Титрование повторяют три раза, допустимый разброс в параллельных титрованиях ± 0,1 см3. Находят среднее значение Vт и рассчитывают временную жесткость воды по уравнению (9.3) и далее по уравнению (9.4) вычисляют постоянную жесткость водопроводной воды.
Результаты эксперимента и расчетов заносят в таблицу 10.
6.3 Определение общей и временной жесткости минеральной воды
Последовательность выполнения работы
При определении обоих видов жесткости в колбу для титрования вместимостью 100 см3 с помощью пипетки переносят аликвоту минеральной воды 10,0 см3. Далее проводят все процедуры, описанные в пунктах 6.1 – 6.2. Результаты эксперимента и расчета заносят в таблицу 10.
Таблица 10 – Результаты определения общей, временной и постоянной жесткости воды
(титранты: с(1/2 Na 2 H 2 γ ) = 0,01 моль/дм3 и с (1/1 HCl ) = 0,01 моль/дм3).
| Исследуемый объект | V ал , см3 | Раствор трилона Б, V т , см3 | 0 Жобщая | Раствор соляной кислоты, V т , см3 | 0 Жвременная | 0 Жпостоянная |
| Водопроводная вода | 50,0 50,0 50,0 | |||||
| Минеральная вода «название» | 10,0 10,0 10,0 |
Выписать с этикетки химический состав минеральной воды (ρ(Са2+ ), (ρ(Mg2+ ) и на его основе рассчитать минимальные и максимальные значения общей и временной жесткости:
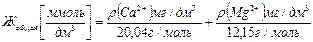
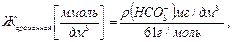
Сравнить результаты расчета и данные эксперимента.








