Таблица 7 – Приготовление методом смешения и исследование свойств ацетатного буферного раствора с
рН = ... (Vбуф. = 60 см3; c нач (НАс) = …моль/дм3; Vр-ра (НАс) = …см3; c нач (NaАс) = … моль/дм3; Vр-ра (NaАс) = … см3).
|
| Приготовлен- ный буферный раствор | Влияние добавок V буф. = 20 см3 n к (НАс) = ….ммоль n осн (NaAc) =…ммоль |
Буферная ёмкость | Влияние разбавления V буф. = 10 см3 V ( Н2О )=10 см3 | ||
| n (Н+) = ….ммоль | n (ОН-) = ….ммоль | В к , моль Н+ /дм3 | Вщ, моль ОН-/дм3 | |||
| Экспериментальные значения рН, Вк и Вщ |
|
| ||||
| Теоретически рассчитанные значения рН, Вк и Вщ |
|
| ||||
По аналогии составляется таблица в случае приготовления и исследования свойств аммиачного буферного раствора.
Все расчеты должны быть представлены в отчете. Выводы по результатам эксперимента должны показать корреляции между теорией и экспериментом.
Задачи для самостоятельного решения
1. В одном литре воды поглощено 5,6 дм3 NH3 (н.у.), после чего через раствор пропустили 2,24 дм3 (н.у.) хлороводорода, который полностью поглотился. Затем к полученному раствору добавили 50,0 см3 0,5 М раствора соляной кислоты. На каком этапе образовался буферный раствор? Вычислите его рН. Как изменится рН при добавлении соляной кислоты? Объясните, образовавшийся буферный раствор более устойчив к добавлению Н+ или ОН–?
(Ответ:…)
2. Рассчитайте, какую массу NаОН надо прибавить к 100 см3 0,1 М раствора уксусной кислоты, чтобы образовался буферный раствор, рН которого а) 4,5; б) 5,0? Рассчитайте теоретическую буферную емкость каждого из полученных таким образом буферных растворов по кислоте, по щелочи.
(Ответ:…)
Решение задач приложить к отчету.
7 . Тема 5. Гетерогенные равновесия и процессы .
К малорастворимым электролитам относят соли и основания, для которых в таблице растворимости стоят символы «м» и «н». Под растворимостью малорастворимого электролита АnBm при данной температуре понимают молярную концентрацию S [моль/дм3] его насыщенного водного раствора, находящегося в равновесии с осадком данного вещества. Это равновесие количественно характеризуют величиной константы равновесия, которую называют произведением растворимости и обозначают ПР (АnBm). Величина ПР зависит от природы электролита и температуры, но не зависит от химического состава раствора над осадком, ее значение приводится в справочниках для температуры 25 0С. Произведение растворимости – одно из важнейших понятий, которые количественно характеризуют состояние равновесия в гетерогенных системах, характеризуют процессы, протекающие с образованием труднорастворимых соединений (осадков). Подобные равновесия имеют место в процессах жизнедеятельности, например, образование нерастворимых соединений (камней) приводит к возникновению желчекаменной или почечнокаменной болезни, при решении ситуационных задач, связанных с образованием и укреплением костной ткани, зубной эмали, а также экологических задач. Решение их может быть эффективным с привлечением теории гетерогенных равновесий.
7.1. Равновесие осадок малорастворимого электролита – его насыщенный раствор Произведение растворимости и растворимость. Условия образования осадка при смешивании растворов электролитов и его растворения. Расчет растворимости малорастворимых электролитов в воде и растворах, содержащих другие электролиты.
Растворимость малорастворимых соединений определяется молярной концентрацией его насыщенного при данной температуре раствора, находящегося в равновесии с осадком. Насыщенный раствор содержит максимально возможное при данных условиях количество растворенного вещества.
Количественно растворимость веществ выражается молярной концентрацией малорастворимого соединения в насыщенном над осадком растворе – S [моль/дм3] и называется молярной растворимостью.
В насыщенных водных растворах сильного электролита устанавливается динамическое равновесие между осадком и его ионами в насыщенном над осадком растворе, причем равновесная концентрация каждого из этих ионов остается постоянной вплоть до вмешательства извне.
Ненасыщенный раствор малорастворимого электролита – устойчивая неравновесная система, в которой концентрация вещества меньше, чем в насыщенном растворе; если создать условия, при которых раствор над осадком становится ненасыщенным, то равновесие в системе будет нарушено и смещено в направлении растворения осадка вплоть до образования насыщенного раствора.
Пересыщенный раствор – неустойчивая псевдоравновесная система, в которой концентрация вещества больше, чем в насыщенном растворе. Пересыщенные растворы являются гомогенными системами, но при определенных условиях самопроизвольно выделяют растворенное вещество, превращаясь в гетерогенные системы (насыщенный раствор в равновесии с осадком).
Количественно равновесие в насыщенных растворах малорастворимых соединений характеризуется величиной произведения растворимости ПР. Величина ПР зависит от природы электролита и температуры, но не зависит от химического состава раствора над осадком, ее значение приводится в справочниках для температуры 25 0С.
Для равновесия
ВaSO4 (тв) Û ВaSO4(p) ® Ba(p)2+ + SO4(p)2-
произведение растворимости (ПР) сульфата бария ВaSO4 есть произведение равновесных молярных концентраций его ионов в насыщенном над осадком растворе, взятых в степенях, равных их стехиометрическим коэффициентам в равновесном процессе:
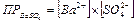 (7.1)
(7.1)
при постоянной температуре произведение растворимости является величиной постоянной.
В более строгих расчетах заменяется произведением активности ионов малорастворимого соединения.
Для большинства малорастворимых соединений значение ПР приведены в справочниках.
7.1.1.Расчет молярной растворимости малорастворимых соединений в воде.
Пусть равновесная молярная концентрация насыщенного раствора электролита АnBm над осадком равна S[моль/дм3], а весь растворенный электролит полностью находится в диссоциированном виде (a = 1), тогда
| АnBm (осадок) | Û | АnBm (нас. р-р) | ® | n Az+ (р-р) | + | m Bz- (р-р) |
| Равновесие: | S моль/дм3 | [Аz+] = nS | [Bz-] = mS |
Из выражения для произведения растворимости
ПР (АnBm) = [Аz+]n∙ [Bz-]m = (nS)n∙ (mS)m = nn ∙ mm ∙ Sn+m ( 7 .2)
молярная растворимость электролита S (АnBm), [моль/дм3] равна
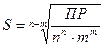 ,
, 
Если установлена молярная растворимость малорастворимого соединения, легко вычислить его массовую концентрацию в насыщенном над осадком растворе:
ρ(АnBm) = S × M(АnBm), 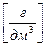 (7.3)
(7.3)
а также массу каждого из ионов малорастворимого соединения в насыщенном над осадком растворе:
m (Аz+) = nS М(Аz+), 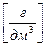 ( 7 .4)
( 7 .4)
m (Bz-) = mS М(Bz-), 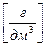 ( 7 .5)
( 7 .5)
7.1.2 Условия смещения ионного гетерогенного равновесия.
Смещение ионного гетерогенного равновесия происходит в соответствии с принципом Ле-Шателье в направлении наиболее полного связывания ионов. Изменение концентрации ионов малорастворимого соединения в насыщенном над осадком растворе, особенно одноименных, приводит к существенному изменению растворимости осадка, при этом величина ПР остается неизменной. Из этой закономерности вытекают следующие четыре правила, лежащие в основе:
– образования осадка;
– растворения осадка;
– последовательности осаждения ионов;
– достижения полноты осаждения ионов.
Образование осадка.
Осадок малорастворимого соединения АnBm выпадает из пересыщенного раствора, когда стехиометрическое произведение молярных концентраций его ионов в растворе станет больше величины ПР (АnBm), т.е., выполняется неравенство:
сn(Аz+) ∙ сm(Bz-) > ПР (АnBm) ( 7 .6)
Выпадение осадка продолжается до тех пор, пока раствор не станет насыщенным.
Растворение осадка.
Осадок малорастворимого соединения АnBm начнет растворяться в том случае, если раствор над ним станет ненасыщенным, когда стехиометрическое произведение молярных концентраций его ионов в растворе станет меньше величины ПР (АnBm), т.е., выполняется неравенство:
сn(Аz+) сm(Bz-) < ПР(АnBm) ( 7 .7)
Создать условия для растворения осадка малорастворимого электролита можно за счет химического связывания хотя бы одного их его ионов в растворе над осадком в комплексное соединение или другое менее диссоциируемое соединение или путем изменения степени окисления одного из ионов (обоих) малорастворимого соединения, или другим способом.
Примеры:
1) Малорастворимые соли слабых кислот, например, карбонаты и фосфаты, растворяются в сильных кислотах, где вносимые ионы Н+ связывают анионы солей в малодиссоциирующие соединения:
| BaCO3(осадок) | Û | BaCO3(нас. р-р) | ® | 3 Ba2+ (р-р) | + | 2 СO32– (р-р) |
| СO32–(нас. р-р) | + | 2 Н+(добавка) | ® | Н2СО3 | ® | СО2↑ + Н2О |
Заметим, что малорастворимый сульфат бария ВаSО4 в кислотах не растворяется – почему?
2) Малорастворимый гидроксид алюминия Al(OH)3 можно растворить как в сильных кислотах, так и в щелочах за счет связывания иона ОН– в воду, а иона Al3+ в комплексное соединение:
| Al(OH)3 (осадок) | Û | Al(OH)3 (нас. р–р) | → | Al3+(р–р) | + | 3ОН–(р–р) |
| Al3+(р–р) | + | 4ОН–(добавка) | → | [Al(OH)4]–(р–р) | ||
| ОН–(р–р) | + | Н+(добавка) | → | Н2О | ||
3) Осадок хлорида серебра растворяется в водном растворе аммиака, т.к. взаимодействуя с аммиаком, образует водорастворимый комплекс [Ag(NH3)2Cl], устойчивый при избытке аммиака в растворе.
Подавить растворимость малорастворимого электролита можно, если в насыщенный раствор внести растворимый сильный электролит, при диссоциации которого образуются ион, одноимённый с ионом малорастворимого электролита.








