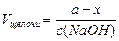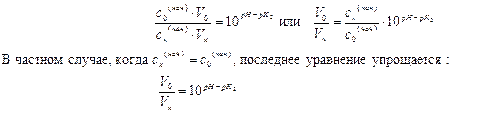Способы приготовления буферных растворов с заданным значением рН.
Существует два способа приготовления буферных растворов:
1) путем смешения водных растворов сопряжённых кислоты и основания.
2) путем частичной нейтрализации слабой кислоты – щёлочью или слабого основания – сильной кислотой.
Второй способ широко используется в лабораторной практике при приготовлении буферных смесей с использованием рН – метра, когда нейтрализацию ведут до заданного значения рН, величину которого контролируют по прибору.
1. Приготовить фосфатный буфер объемом Vбуф с заданным значением рН методом смешения растворов дигидрофосфата и гидрофосфата натрия.
1.1 Определим объемы Vк и V0 исходных растворов сопряжённых кислоты и основания, если известны исходные концентрации c к(нач) и c осн(нач) .
Для расчёта необходимо составить два уравнения, первое из которых очевидно
Vбуф = Vосн + Vк (6.4)
а второе получим на основе уравнения (6.2).
Поскольку количества солей в буферном растворе равно их количеству в соответсвующих объёмах исходных растворов, то
n осн (в буферном растворе) = c осн(нач) Ч Vосн,
n к (в буферном растворе) = c к(нач) Ч Vк
Подставляя эти величины в уравнение (6.2), находим второе уравнение связи между искомыми объёмами:
|
| (6.5) |
| (6.6) |
Решая систему из двух уравнений (6.4) и (6.5) или (6.4) и (6.6), находим объёмы растворов Vк и Vосн, при смешении которых образуется буферный раствор с заданным значением рН.
2. Этот же буферный раствор можно приготовить путём частичной нейтрализации фосфорной кислоты щёлочью, например NaOH.
Пусть в растворе фосфорной кислоты объёмом V [дм3] и молярной концентрацией c (Н3РО4) [моль/дм3] содержится n (Н3РО4) = c (Н3РО4)Ч V = а моль Н3РО4. Гидрофосфатный буферный раствор содержит смесь двух солей Na2HPO4 (осн) / NaH2PO4(к), поэтому расчеты при нейтрализации кислоты проводят в два этапа: перевод а моль фосфорной кислоты в дигидрофосфат – ион (I этап) и далее частичный перевод дигидрофосфат-иона в гидрофосфат-ион до нужного значения рН (II этап) – решение задач на избыток-недостаток:
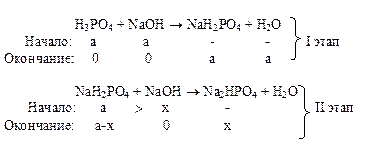
Необходимое количество щёлочи х для осуществления второго этапа определяют по уравнению (6.2):
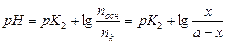
Общее количество NaOH равно nобщ.(I+II этапы) = а + х, и если в исходный раствор фосфорной кислоты добавляют кристаллический NaOH, то его масса равна
m (NaOH) = =(a+x) Ч M (NaOH);
если добавляют раствор щёлочи, то его объём равен: