Особенности равновесий в буферных растворах и механизм буферного действия.
Все дальнейшее обсуждение свойств буферных растворов и расчёты будут проведены на примере гидрофосфатного буферного раствора:
Na2HPO4 (осн), NaH2PO4 (к)
Соль NaH2PO4 (к), выполняющая роль кислоты, диссоциирует в буферном растворе на ионы:
|
| α=1 | ||||
| NaH2PO4 | ® | Na+ | + | H2PO4– | |
| ск | ск | ||||
|
| α®0 | ||||
| H2PO4– | Û | H+ | + | HPO42– | |
| равновесные концентрации ионов | ск | ||||
| ск (1-α) | α ск |
где с k– концентрация дигидрофосфата натрия (к) в буферном растворе, а α – степень диссоциации фосфорной кислоты по второй ступени.
Соль Na2HPO4 (осн), выполняющая роль сопряжённого основания, диссоциирует в буферном растворе на ионы и частично гидролизуется по аниону:
|
|
| α=1 | |||||
| Na2HPO4 | ® | Na+ | + | H2PO4– | |||
| cо | cо | ||||||
|
| h®0 | ||||||
| HPO42– | + | H2O | Û | H2PO4– | + | OH– | |
| равновесные концентрации ионов | cо | ||||||
| cо (1-h) | h с o | ||||||
где со – концентрация гидрофосфата натрия(осн) в буферном растворе, а h – степень гидролиза гидрофосфат - ионов.
В буферном растворе ионы H2PO4–, образующиеся при диссоциации NaH2PO4 (к) и являющиеся донорами протонов Н+, подавляют гидролиз ионов HPO42–, образующихся при диссоциации Na2HPO4 (осн) и выполняющих роль акцептора протонов, и наоборот, ионы HPO42– подавляют диссоциацию ионов H2PO4–. Это означает, что равновесные концентрации анионов практически совпадают с исходными аналитическими концентрациями солей (кислоты и сопряженного основания) в буферном растворе:
[H2PO4–] = (1-α)Чck(NaH2PO4)a » 0 » ck (NaH2PO4)
[HPO42–] = (1-h)Ч cо(Na2HPO4)h » 0 » c0(Na2HPO4).
Буферное действие фосфатного буферного раствора обеспечивается за счёт смещения равновесия, существующего между ионами H2PO4– и HPO42– в буферном растворе при добавлении сильной кислоты или щелочи, которое является результатом протекания реакций между компонентами буферного раствора и добавляемыми ионами водорода или гидроксила:
а) при добавлении сильной кислоты HnX в буферный раствор поступает количество добавленных ионов водорода:
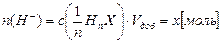
сопряжённое основание буферной системы связывает ионы Н+, в результате чего общее содержание сопряженной кислоты в буферном растворе растёт, а основания – уменьшается, а активная кислотность буферного раствора – рН - остаётся неизменной или незначительно уменьшается:
HPO42– + H+(добавка) ® H2PO4– – ионная форма уравнения буферного действия.
| Na2HPO4 | + | HCl | ® | NaH2PO4 | + | NaCl | молекулярная форма | |||
| начало | nо | > | x (доб.) | nk | ||||||
| окончание | nо- x |
| 0 | nk+x | количество после утилизации Н+ | |||||
б) при добавлении щёлочи М(ОН)n в буферный раствор поступает количество введенных гидроксид-ионов:
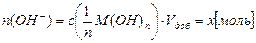
сопряженная кислота буферной системы связывает введенные ионы ОН–, в результате чего общее содержание сопряженного основания в буферном растворе растёт, а кислоты – уменьшается, но активная кислотность буферной смеси – рН остаётся неизменной или незначительно увеличивается:
H2PO4- + OH– (добавка) ® HPO42–+ H2O – ионная форма уравнения буферного действия.
| NaH2PO4 | + | NaOH | ® | Na2HPO4 | + | H2O | молекулярная форма | |||
| начало | nk | > | x (доб.) | no | ||||||
| окончание | nk- x |
| 0 | no+x | количество после утилизации OH- | |||||
Буферное действие по отношению к кислотам и щелочам сохраняются до тех пор, пока количества компонентов буферной системы, связывающих ионы Н+ или ОН–, будут больше количеств этих ионов, поступающих в буферный раствор извне.








