6 . Тема 4. Т еория кислот и оснований Аррениуса и Бренстеда-Лоури. Сопряженные кислотно-основные пары. Буферные растворы.
Протолитическая теория кислот и оснований Н.Бренстеда и Т.Лоури (1923) не противоречит электролитической теории (ТЭД) кислот и оснований Аррениуса, а позволяет расширить круг веществ, обладающих кислотно-основными свойствами:
кислота – частица (молекула или ион), являющаяся донором протонов Н+ или акцептором ионов ОН– (ТЭД Аррениуса: кислоты –вещества, при диссоциации молекул которых образуются только катионы Н+);
основание – частица (молекула или ион), являющееся акцептором протонов Н+ (ТЭД Аррениуса: основания – вещества, при диссоциации молекул которых образуются анионы только ОН–).
Кислота, отдавая Н+, образует сопряженное основание. Вместе они – сопряженная кислотно-основная пара.
Примеры:
| 1) | СН3СООН | Û | Н+ | + | СН3СОО- |
| кислота | основание |
| 2) | NH3 | + | Н+ | Û | NH4+ |
| основание | кислота |
Буферные растворы – это растворы, способные сохранять заданное значение рН при разбавлении или добавлении в раствор небольших количеств сильной кислоты или щёлочи. Последнее свойство называется буферным действием, и оно связано со строго определённым химическим составом растворов – буферные растворы содержат два находящихся в равновесии друг с другом компонента – кислоту и сопряженное основание, которые образуют сопряжённую кислотно-основную пару. Первый из них связывает в малодиссоциирующее соединение вносимые в раствор ионы ОН–, выполняя роль кислоты, а второй – связывает вносимые в раствор ионы Н+, выполняя роль основания. В данном случае понятия кислоты и основания соответствуют протолитической теории кислот и оснований Н. Бренстеда и Т. Лоури.
По химическому составу буферные растворы делят на кислотные и основные:
1) кислотные буферные растворы – роль кислоты (к) выполняет слабая кислота или её кислая соль, а сопряжённым основанием (осн) является средняя соль этой кислоты или её кислая соль с большей степенью замещения ионов водорода на ион металла.
Примеры:
а) Уксусная кислота и её соль при совместном их присутствии в растворе образуют ацетатный буфер:
СН3СООН (к)
СН3СООNa (осн)
б) Фосфорная кислота и её соли могут образовывать три типа буферных систем:
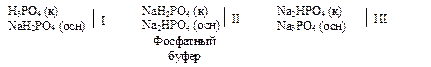
в) Угольная кислота и её соли могут образовывать два типа буферных систем:
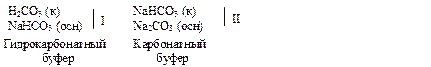
2) основные буферные растворы – роль основания (осн) выполняет слабое основание, роль кислоты (к) – соль этого слабого основания.
 Пример: NH4OH (осн) Аммиачный
Пример: NH4OH (осн) Аммиачный
NH4Cl (к) буфер
При записи состава буферного раствора рекомендовано первым указывать состав основания буферной смеси, затем, через запятую, кислоту. Называют буферный раствор по названию частицы, выполняющей роль основания.








