III Гидролиз солей
1. К 100 см3 раствора карбоната натрия (ω(Na2CO3) = 2,0 % и ρр-р = 1,019 г/см3) добавили 250 см3 дистиллированной воды. Как изменились значение рН раствора и степень гидролиза соли. (Ка2 (Н2СО3) = 4,69∙10–11).
(Ответ: рН1= 11,81 , h1=3,33 % ; рН2 = 11,53 , h1=6,23 %)
2. Сколько граммов фосфата натрия Na3PO4 нужно растворить в 750 см3 воды, чтобы получить раствор с рН = 12. Для расчета использовать точную формулу. (Ка3 (Н3РО4) = 1,26∙10–12).
(Ответ: 2,78 г)
3. Как различаются степени гидролиза соли и рН в растворах карбоната (К2СО3) и сульфита (К2SО3) калия с одинаковой молярной концентрацией солей. (Ка2 (Н2СО3) = 4,69∙10–11 и Ка2 (Н2SО3) = 6,31∙10–8).
(Ответ: h(К2СО3) = 36,68 h(К2SО3); рН(К2СО3) – рН(К2SО3) = 1,56)
4. На титрование аликвоты 10,0 см3 раствора уксусной кислоты (ω(СН3СООН) = 3,0 % и ρр-р = 1,00 г/см3) пошло 15,0 см3 щелочи. Сравните рН начального и конечного растворов. Какой индикатор необходимо использовать для фиксации точки эквивалентности. (Ка (СН3СООН)= 1,754∙10–5).
(Ответ: рНисходн.= 2,53; рНконечн.= 9,03 – нужно использовать фенолфталеин)
5. Смешали 100 см3 раствора хлорида аммония с(NH4Cl) = 0,01 моль/дм3 и 500 см3 раствора бромида аммония с(NH4Br) = 0,025 моль/дм3. Какую окраску будет иметь смесь при добавлении к ней метилоранжа. (Кb(NH4OH) = 1,79∙10–5).
(Ответ: определить суммарную концентрацию иона NH4+; рН=5,56 – раствор желтый)
6. В 150 см3 раствора сульфита натрия Na2SO3 содержится 138 мг ионов натрия. Определите молярные концентрации ионов и соли в растворе. Вычислите рН этого раствора (Ка2(Н2SO3) = 6,31∙10–8).
(Ответ: с(Na+) = 0,04 моль/дм3; с(SО32–) = с(Na2SO3) = 0,02 моль/дм3; pH= 9,75)
ОБУЧАЮЩИЕ ЗАДАЧИ
1. Вычислить константу гидролиза Кг, степень гидролиза h и рН раствора хлорида аммония с концентрацией соли с(NH4Cl)=0,01 моль/дм3.
Решение:
1) соль NH4Cl образована сильной кислотой HCl и слабым основанием NH4OH – гидролиз по катиону; гидролиз соли – процесс обратимый.
NH4Cl + H2O = NH4OH + HCl
NH4+ + H2O Û NH4OH + H+ – в результате гидролиза образуются ионы Н+, т.е. среда в растворе кислая.
2) константу гидролиза Кг рассчитывают по формуле:
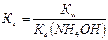 ,
,
где Кw – ионное произведение воды, К w =10-14 (25 0С); К b (NH4OH) – константа ионизации основания (справочная величина), К b (NH4OH)=1,74·10-5.
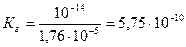
3) степень гидролиза h соли рассчитывают по формуле:
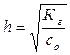 ,
,
где cо – молярная концентрация соли в растворе.
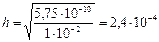
4) концентрация Н+ ионов равна концентрации гидролизованной части соли и ее определяют по формуле:
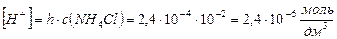
5) 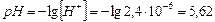
Ответ: константа гидролиза соли NH4Cl равна 5,75·10-10; степень гидролиза составила 2,4·10-4; рН раствора равен 5,62.
2. Определить константу гидролиза, степень гидролиза и рН раствора ацетата калия, если концентрация с(СН3СООК)=0,1моль/дм3, а Ка(СН3СООН)=1,8·10-5.
Решение:
1) соль CH3COOK образована слабой кислотой CH3COOH и сильным основанием KOH – гидролиз по аниону, среда в результате гидролиза щелочная:
CH3COOK + H2O = CH3COOH + KOH;
СH3COO- + H2O Û CH3COOH + OH- – накапливаются ионы ОН-, среда щелочная.
2) константу гидролиза Кг рассчитывают по формуле:
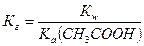 ,
,
где Ка – константа ионизации кислоты. 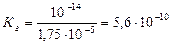
2) степень гидролиза h соли рассчитывают по уравнению:
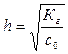 ,
,
где с0 – концентрация соли в растворе.
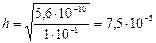
3) концентрация ОН– – ионов равна концентрации гидролизованной части соли:
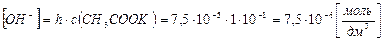
4) 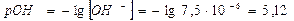
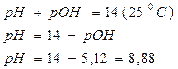
Ответ: константа гидролиза соли CH3COOK равна 5,6·10-10; степень гидролиза составила 7,5·10-5; рН раствора 8,88.
3. В результате реакции гидролиза гидрокарбоната натрия в его растворе создается слабощелочная среда. Рассчитайте рН раствора, содержащего 10 г гидрокарбоната натрия в 200 см3 раствора, если степень гидролиза равна 0,01 %.
Решение:
1) соль NaHCO3 – кислая соль слабой угольной кислоты и сильного основания – гидролиз по аниону:
NaHCO3 + H2O = NaOH + H2O + CO2
HCO3- + H2O Û OH- + H2O + CO2 – среда щелочная
2) концентрация ОН- - ионов равна концентрации гидролизованной части соли:
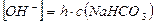 , где h – степень гидролиза соли, а с(NaHCO3) – молярная концентрация соли в растворе:
, где h – степень гидролиза соли, а с(NaHCO3) – молярная концентрация соли в растворе:
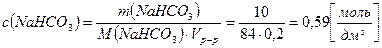 ,
,
тогда 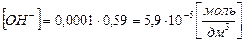
3) 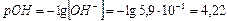
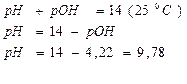
Ответ: рН = 9,78.








