Гидролиз солей. Вычисление рН в растворах гидролизующихся солей.
Гидролиз – это вторичный равновесный процесс взаимодействия с диполями воды ионов соли, возникающих в результате первичного процесса – полной (необратимой) диссоциации молекул соли, в результате чего изменяется соотношение равновесных концентраций ионов H+ и OH– в водном растворе соли по сравнению с чистой водой. В случае многозарядных ионов соли их гидролиз идёт ступенчато и при расчётах pH растворов гидролизующихся средних солей учитывают гидролиз лишь по первой ступени. В растворах солей, образованных сильными кислотами и щёлочами, гидролиз отсутствует, и величина pH воды сохраняется.
Различают несколько типов гидролиза:
а) гидролиз по катиону соли – соль образована слабым основанием и сильной кислотой (на примере соли FeCl3):
первичный процесс – полная (необратимая) диссоциация соли:
FeCl3 ® Fe3+ + 3Сl– ,
вторичный процесс – обратимый ступенчатый гидролиз иона Fe3+:
I – ступень: Fe3+ + H2O Û FeOH2+ + H+ , pH < 7
II – ступень: FeOH2++ H2O Û Fe(OH)2 ++ H+ и т.д.
Таким образом, растворы гидролизующихся по катиону солей являются кислыми.
б) гидролиз по аниону соли – соль образовании сильным основанием и слабой кислотой (на примере соли Na3PO4):
первичный процесс – полная (необратимая) диссоциация соли:
Na3PO4 → 3Na+ + PO43- ,
вторичный процесс – обратимый ступенчатый гидролиз по аниону PO43-:
I – ступень: PO43- + H2O Û HPO42- + OH- , pH > 7
II – ступень: HPO42-+ H2O Û H2PO4- + OH- и т.д.
Таким образом, растворы гидролизующихся по аниону солей являются щелочными.
Методика расчёта pH в растворах средних гидролизующихся солей.
Рассмотрим методику расчёта pH в растворах гидролизующихся солей. Равновесные концентрации участников процесса гидролиза по каждой ступени (вода не учитывается) связаны друг с другом через соответствующую константу гидролиза Кг, которую рассчитывают по следующему правилу:
константа гидролиза Кг равна частному от деления ионного произведения воды К w = 10–14 на константу диссоциации Ка слабой кислоты (К b слабого основания), которые образовались в результате гидролиза.
Пример. Слабая ортофосфорная кислота диссоциирует по трем ступеням :
H3PO4 → H2PO4– → HPO42– → PO43–
константы диссоциации Kа1 Kа2 Kа3
при этом образуются три типа анионов, способных к гидролизу.
Ион PO43– гидролизуется по трем ступеням и каждая из них имеет свою константу гидролиза: PO43- → HPO42- → H2PO4- → H3PO4.
Константа гидролиза : Kг1 = Кw / Ка3;
Kг2 = Кw / Ка2;
Kг3 = Кw / Ка1.
Степень гидролиза h – количественная характеристика равновесия гидролиза соли, которая, в отличие от константы гидролиза, зависит от молярной концентрации гидролизуемого иона в растворе: h = сгидр / со, откуда с гидр = h ∙ со
В качестве примера рассмотрим простейший случай расчета pH в растворе средней соли, например, фосфата натрия с молярной концентрацией с0 [моль/дм3].
| Na3PO4 | → | 3Na+ | + | PO43– |
| со | 3со | со |
Обозначим степень гидролиза иона PO43– по первой ступени через h1 (h1<<1), тогда к моменту установления равновесия подверглось гидролизу сгидр. (PO43–) = h1·с0 соли:
| PO43– | + | H2O | ↔ | HPO42– | + | OH– | |
| до гидролиза | со моль/дм3 | – | – | ||||
| равновесие | [PO43-] = со – сгидр. = со (1 – h1) | [HPO42-] = h1 со | [OH–] = h1со |
Гидролизующийся ион PO43– образовался по третьей ступени диссоциации фосфорной кислоты, поэтому
Кг1 = 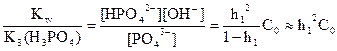 ,
,
Откуда h1 = 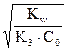 , [OH–] = h1 С0 =
, [OH–] = h1 С0 = 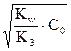
и pOH = - lg [OH–], а pH = 14 – pOH .
Заметим, что использование упрощенной формулы (1 << h1) возможно, если константа гидролиза Кг < 10–3, концентрация иона со > 0,001 моль/дм3; в противном случае следует проводить вычисления по общей формуле.
Расчет рН в растворах кислых солей более сложен, поскольку анион может участвовать в двух конкурирующих процессах – гидролиза и диссоциации. Тем не менее, можно легко определить характер среды в растворе, сравнивая константы равновесия этих процессов: преобладает тот из них, у которого константа больше.
Пример . В растворе гидрофосфата натрия
Na2HPO4 → 2 Na+ + HPO42–,
причем ион HPO42– может далее
а) диссоциировать по III ступени: HPO42– ↔ PO43– + Н+;
Ка3(Н3РО4) = 1,26·10–12
б) гидролизоваться: HPO42– + H2O ↔ H2PO4– + OH–
Кг = Кw / Ка2(Н3РО4) = = 10–14 / 6,34·10–8 = 1,57·10–7.
Очевидно, что преобладает процесс гидролиза HPO42– и раствор данной соли слабощелочной.
Лабораторная работа №3.
Равновесия в растворах электролитов








