Примечание: в не слишком разбавленных водных растворах вместо концентрации ионов используют их активности.
ОБУЧАЮЩИЕ ЗАДАЧИ
1. Вычислить ионную силу в растворе 0,1 моль/дм3 сульфата натрия.
Решение:
| Na2SO4 | → | 2Na+ | + | SO42- | |
c [ 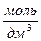 ]: ]:
| 0,1 | 0,2 | 0,1 |
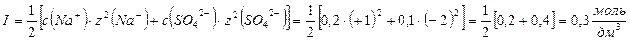 Ответ: ионная сила 0,1 моль/дм3 Na2SO4 равна 0,3 моль/дм3.
Ответ: ионная сила 0,1 моль/дм3 Na2SO4 равна 0,3 моль/дм3.
2. Вычислить концентрацию ионов ОН-, рОН и рН в растворе с молярной концентрацией аммиака 0,1 моль/дм3 (Кb=1,76·10-5).
Решение:
NH3 + H2O Û NH4OH Û NH4+ + OH-
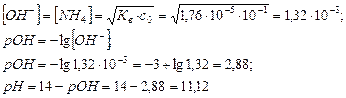
Ответ: [ОН-]=1,32·10-3; рОН=2,88; рН=11,12.
3. Константа диссоциации уксусной кислоты равна 1,75 10-5. Определите массу ацетата натрия, которую необходимо добавить к 300 см3 0,1 моль/дм3 раствора уксусной кислоты, чтобы понизить концентрацию ионов водорода в растворе в 100 раз.
Решение:
Найдём равновесную концентрацию ионов водорода в 0,1 моль/дм3 растворе CH3COOH:
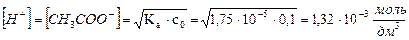 .
.
При добавлении CH3COONa концентрация ионов H+ должна быть в 100 раз меньше (диссоциация частично подавлена), т.е. 1,32 ∙ 10-5 моль/дм3. Пусть необходимо внести в 1 дм3 исходного раствора кислоты х моль соли, что соответствует добавке x моль ацетат- ионов, тогда равновесные концентрации равны:
[H+] = 1,32×10-5 моль/дм3
[CH3COO-] = (x + 1,32 ∙ 10-5) моль/дм3» x моль/дм3
[CH3COOH] = с0 – [H+] = 0.1 – 1.32× 10-5 » 0,1 моль/дм3
и, подставив значения равновесных концентраций в выражение для константы диссоциации уксусной кислоты:
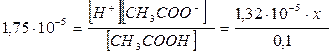
Находим: x = 0,133 моль, что соответствует концентрации соли с(CH3COONa) = 0,133 моль/дм3.
Масса добавки ацетата натрия к 300 см3 раствора равна:
m (CH3COONa) = с(CH3COONa) × Vр-р × M (CH3COONa) = 0,133 × 0,3 × 82 = 3,27 г
Ответ: m (CH3COONa) = 3,27 г.
Вычисление рН в водных растворах кислот и оснований
В водных растворах кислот и оснований рН среды зависит от природы и концентрации растворенного вещества.
При вычислении рН раствора сильной кислоты или сильного основания необходимо знать молярную концентрацию с0 сильной кислоты или сильного основания. Так как диссоциация сильной кислоты или сильного основания – процесс необратимый, то для расчетов рН используют следующие уравнения:
рН = –lg c(H+) = –lg c0(HAn),
где с0(НAn) – молярная концентрация сильной одноосновной кислоты, моль/дм3.
Для серной кислоты:
рН = –lg c (H+) = –lg 2c0(H2SO4).
Для сильного основания (щелочи):
[OH-] = c0 (KtOH),
где с0(KtOH) – молярная концентрация однокислотного основания в растворе, тогда
[H+]= 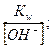 рН=14+lg co(KtOH).
рН=14+lg co(KtOH).
В растворах с высокой ионной силой вместо концентрации ионов Н+ или ОН- используют их активности:
а(Н+)=с(Н+)·f(H+); a(OH-)=c(OH-)·f(OH-).
При вычислении рН раствора слабой кислоты или слабого основания необходимо знать молярную концентрацию этого вещества и константу его диссоциации (Ка или Кb).
Пусть НАс – слабая одноосновная кислота с молярной концентрацией с0 и степенью диссоциации α:
| HАс | Û | H+ | + | Ас– | |
| до диссоциации: | с0 | – | – | ||
| равновесие: | с0- α с | α c0 | α c0 |
Согласно формуле (5.8), учитывая, что равновесная концентрация ионов водорода 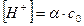 , получаем:
, получаем:
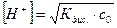
рН = –lg [H+].
В растворах слабых оснований (NH4OH) находят равновесную концентрацию ОН-: 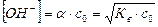 , после чего рассчитывают рН:
, после чего рассчитывают рН:
рН = 14 – рОН








