Диссоциация слабого основания.
Диссоциация воды. Ионное произведение воды К w.
Аналогичные по форме соотношения можно получить при расчёте равновесия диссоциации слабого основания, например, гидроксида аммония NH4OH:
NH4OH Û NH4+ + OH-
a » 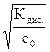 и [OH-] = [NH4+] = a × с0 =
и [OH-] = [NH4+] = a × с0 = 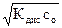 , (5.10)
, (5.10)
где с0 – молярная концентрация аммиака в его растворе, а Кдис. – справочное значение константы диссоциации гидроксида аммония; константу диссоциации основания обозначают К b (от английского слова base – основание).
Диссоциация слабого электролита – обратимый процесс, в котором положение равновесия можно смещать влево (подавление диссоциации) за счёт добавления в раствор сильных электролитов, содержащих одноимённый ион. Смещение равновесия вправо достигается за счёт связывания продуктов диссоциации в менее диссоциируемое соединения. Например, диссоциацию уксусной кислоты можно подавить за счёт добавления в её раствор ацетата натрия или сильной кислоты, поставляющей в раствор Н+, и наоборот, усилить, связывая ионы водорода ионами ОН– в молекулы воды.
Особый интерес представляет диссоциация воды – слабого амфотерного электролита:
H2O Û H+ + OH-,
равновесные концентрации ионов и нераспавшихся на ионы молекул воды связаны друг с другом через константу диссоциации воды:
Кдис. = 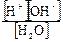 ;
;
величина Кдис. может быть вычислена при любой температуре на основании данных измерения электропроводности чистой воды. При 22 0С Кдис. равна 1,8·10-16; пренебрегая ничтожно малой степенью диссоциации воды, концентрацию молекул воды как в чистой воде, так и в разбавленных водных растворах можно считать величиной постоянной:
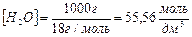 .
.
Тогда выражение для константы диссоциации можно переписать:
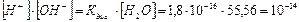
произведение [Н+]·[ОН-]=10-14 называют ионным произведением воды и обозначают К w: [ OH-]·[ H+]=К w=10-14 (5.11)
Для чистой воды и для разбавленных водных растворов любых веществ ионное произведение воды К w при данной температуре является величиной постоянной и равно10-14. С повышением температуры К w возрастает, с понижением – уменьшается. Так, например, при 100 оС ионное произведение воды К w =10-12.
Используя величину ионного произведения воды Кw и известную концентрацию одного из ионов воды, исходя из формулы (5.11), можно вычислить концентрацию ионов Н+ или ОН- в любом водном растворе:
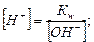
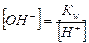 .
.
В чистой воде из условия электронейтральности:
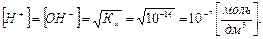
Растворы, в которых [Н+]=[ОН-] =10-7 моль/дм3, называются нейтральными.
Если [H+] > [OH-] > 10-7 моль/дм3 (>10-6...10-1моль/дм3) растворы называются кислыми, если [H+] < [OH-] < 10-7моль/дм3 – щелочными растворами (<10-8...10-14 моль/дм3).
На практике кислотность раствора в водных средах принято характеризовать не молярной концентрацией ионов водорода или гидроксила, а безразмерной величиной – водородным показателем рН.
Водородный показатель рН – количественная характеристика кислотности среды – величина, равная отрицательному десятичному логарифму равновесной концентрации ионов водорода в растворе:
рН = –lg[H+].
Аналогично гидроксильный показатель рОН:
рОН = –lg[OH-].
В любом водном растворе [OH-]·[H+] = Кw=10-14 (при 220С). Логарифмируя это выражение, получаем:
рН + рОН = 14 (5.12)
В нейтральной среде рН = рОН = 7,0; в кислой среде рН < 7,0; в щелочной – рН > 7,0. В разбавленных водных растворах различных веществ величина рН меняется от 0 до 14.








