Расчёт концентраций ионов и недиссоциированных молекул в растворах
слабых электролитов (α ® 0, сдисс. = α × с0). Закон разбавления Оствальда.
Диссоциация слабой кислоты
Слабые кислоты диссоциируют обратимо; слабые многоосновные кислоты – обратимо и ступенчато.
Пусть молярная концентрация приготовленного раствора слабой кислоты равна с0, а ее степень диссоциации 0 < a << 1; к моменту установления равновесия продиссоциировало сдис. = a с0 кислоты, тогда:
| HХ | Û | H+ | + | Х- | |
| до диссоциации: | с0 | – | – | ||
| равновесие: | [HX] = с0 – сдисс.= = с0 (1 – a) | [H+] = a c0 | [X–] = a c0 |
Молярные концентрации всех компонентов раствора в состоянии динамического равновесия называют равновесными концентрациями и записывают их в квадратных скобках.
Связь между равновесными концентрациями осуществляется через константу диссоциации, величину которой при необходимости можно найти в справочнике:
Кдис. = 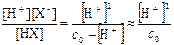 , (5.7)
, (5.7)
где для слабых электролитов часто используют приближённую формулу, считая, что с0 – [H+] » с0, поскольку с0 >> сдис. = [H+].
C другой стороны, в выражение для константы диссоциации, можно ввести степень диссоциации:
Кдис. = 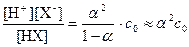 ,
,
откуда следует: α » 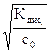 (5.8)
(5.8)
Зависимость степени диссоциации слабого электролита от его природы (Кдис.) и концентрации в растворе называют законом разбавления Оствальда: при разбавлении раствора слабого электролита степень его диссоциации растет.
Концентрацию ионов водорода в растворе слабой кислоты с учетом (5.7) рассчитывают по уравнению:
[H+] = [X–] = aс0 = 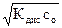 (5.9)
(5.9)
В случае диссоциации слабых многоосновных кислот используется аналогичная расчётная схема, в которой учитывается диссоциация молекул многоосновной кислоты только по первой ступени, а диссоциацией по следующим ступеням пренебрегают, т.к. Кдис. по последующим ступеням достаточно низкие , что является основанием учета диссоциации по первой ступени. В этом случае для расчётов концентрации ионов водорода в растворах слабых многоосновных кислот используют справочныее значения их констант диссоциации по первой ступени. Константу диссоциации кислоты принято обозначать Ка (от английского слова asid - кислота).








