Равновесия в растворах сильных и слабых электролитов
Электролиты по их способности к диссоциации на ионы в водных растворах делят на две группы:
а) сильные электролиты – диссоциируют полностью, необратимо; в растворах сильных электролитов присутствуют только ионы – катионы и анионы;
б) слабые электролиты – диссоциируют обратимо, частично; в растворах слабых электролитов присутствуют как ионы – катионы и анионы, так и недиссоциированные молекулы.
Количественно способность электролитов к диссоциации характеризуют с помощью безразмерной величины – степени диссоциации α, которая определяет долю молекул электролита, распавшихся на ионы, по сравнению с их количеством, внесённым в раствор.
Пусть в воде растворено n0 моль электролита, из которого продиссоциировало nдисс. моль, тогда по определению степени диссоциации:
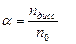 или nдисс. = a × n0 (5.1)
или nдисс. = a × n0 (5.1)
если ввести молярную концентрацию приготовленного раствора электролита с0, то
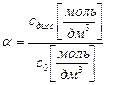 или сдисс. = a × с0 (5.2)
или сдисс. = a × с0 (5.2)
Величина α меняется в пределах 0 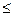 α
α 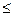 1 или 0
1 или 0 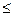 α
α 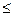 100%.
100%.
если α =0, то nдисс. = 0 – вещество является неэлектролитом,
если α =1, то nдисс.= n0 – вещество относится к группе сильных электролитов (α > 30%),
если α 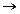 0, то nдисс. << n0 – вещество является слабым электролитом (α < 3%).
0, то nдисс. << n0 – вещество является слабым электролитом (α < 3%).
Степень диссоциации – это характеристика электролита, зависящая от концентрации, Для сравнения силы электролитов в растворе используется физическая величина – константа диссоциации электролита, справочная величина, соответственно, константа кислотности Ка или константа основности Кb.
К группе сильных электролитов относятся (α =1 или α 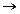 1):
1):
– растворимые в воде соли;
– растворимые и малорастворимые в воде основания (щёлочи) – KOH, NaOH, CsOH, Ba(OH)2, Ca(OH)2, Sr(OH)2, LiOH;
– кислоты – HNO3, HClO4, , H2SO4, НCl, HBr, HI.
К группе слабых электролитов относятся (α 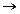 0):
0):
– неорганические кислоты – HNO2, HClO, HCN, HF, H2CO3, H2S, H2SO3, H3PO4;
– органические растворимые в воде карбоновые кислоты – уксусная, муравьиная, пропионовая и др;
– основания – раствор аммиака в воде (NH4OH), водные растворы органических аминов;
– вода – амфотерный электролит (амфолит).
Расчёт концентраций ионов в растворах сильных электролитов (α = 1, сдисс = с0):
| AnBm | ® | n Az+ | + | m Bz- | |
| до диссоциации | с0 | – | – | ||
| после диссоциации | 0 | (Az+) = nс 0 | (Bz-) = mс0 |
| 1) | HCl | ® | H+ | + | Cl- |
| до диссоциации: | с0 | – | – | ||
| после диссоциации: | 0 | с0 | с0 |
Примеры:
| 2) | H2SO4 | ® | 2H+ | + | SO42- |
| до диссоциации: | с0 | – | – | ||
| после диссоциации: | 0 | с(H+) = 2с0 | с(SO42-) = с0 |
| 3) | Al2(SO4)3 | ® | 2 Al3+ | + | 3 SO42- |
| до диссоциации: | с0 | – | – | ||
| после диссоциации: | 0 | с(Al3+)=2с0 | с(SO42-) =3с0 |
Так как процесс диссоциации сильного электролита практически необратим, его нельзя охарактеризовать константой диссоциации.








