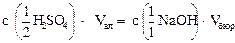Метод нейтрализации (метод кислотно-основного титрования).
Методом нейтрализации можно определять содержание в анализируемых растворах сильных и слабых кислот, растворимых в воде оснований, кислых и гидролизующихся солей (прямое титрование). В качестве реагентов (титрантов) используются стандартные растворы сильных кислот и щелочей.
Стандартными называют водные растворы реагентов с точно известной молярной концентрацией эквивалента вещества в растворе. Точку конца титрования устанавливают в присутствии кислотно-основных индикаторов.
– титрование сильных оснований или сильных кислот.
В результате титрования в точке эквивалентности образуется соль сильного основания и сильной кислоты, которая не гидролизуется; рН раствора = 7. Наиболее подходящий кислотно-основный индикатор, показатель титрования (рТ) которого лежит в слабокислой или слабощелочной области, это растворы фенолфталеина или метилоранжа.
– титрование слабых оснований.
В точке эквивалентности образуется гидролизующаяся соль – соль слабого основания и сильной кислоты. В результате гидролиза соли рН раствора в точке конца титрования будет меньше 7, следовательно, индикатор должен менять свою окраску в кислой среде. Такими свойствами обладают метиловый красный (метилрот), метиловый оранжевый (метилоранж).
– титрование слабых кислот.
При титровании раствора слабой кислоты раствором сильного основания в точке конца титрования образуется соль, вследствие гидролиза которой раствор имеет щелочную реакцию. Для фиксирования точки эквивалентности используют индикатор, способный изменять окраску в слабощелочной среде. Такими свойствами обладают фенолфталеин, тимолфталеин, метилоранж.
Индикаторы в методе кислотно-основного титрования.
Одним из важнейших моментов в кислотно-основном титровании является выбор индикатора, так как только в присутствии подходящего индикатора можно своевременно зафиксировать момент, когда определяемое вещество и реагент прореагируют в эквивалентных количествах – момент конца титрования, и, следовательно, получить правильный результат анализа.
Индикаторы по своей природе подобны веществам, участвующим в данной химической реакции. Так, индикаторы для кислотно-основного титрования представляют собой слабые органические кислоты или основания, растворимые в воде или смешанных водно-органических растворителях.
Специфическое свойство кислотно-основных индикаторов состоит в том, что их молекулярная и ионизированная (солевая) формы значительно отличаются по окраске.
Индикаторы, у которых окрашена только одна форма, называют одноцветными (например, фенолфталеин), в отличие от двухцветных, у которых обе формы окрашены в разные цвета (например, метилоранж). Индикаторы должны иметь интенсивную окраску, чтобы при незначительных их концентрациях (порядка 10-4 – 10-5 моль/дм3) титруемый раствор был бы ими достаточно четко окрашен. Это требование обусловлено тем, что для превращения одной формы в другую индикаторы расходуют некоторое количество стандартного раствора реагента. Следовательно, количество индикатора должно быть минимальным, чтобы существенно не влиять на результат анализа.
Если индикатор представляет собой слабую кислоту (ее формулу можно обозначить HInd), то в водном растворе имеет место следующее равновесие:
HInd + H2O Û H3O++Ind-
или HInd Û H+ + Ind-
При этом окраска молекулярной формы HInd и окраска сопряженного с ней основания Ind- различаются, и то, какую окраску будет иметь раствор, зависит от преобладающей формы индикатора в растворе, которая, согласно равновесию, зависит от величины рН. Константа равновесия является константой диссоциации индикатора (справочная величина), – наиболее важная его характеристика, на основе которой выполняют выбор индикатора:
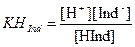 ( 4 .3)
( 4 .3)
Окраска раствора зависит от соотношения концентраций молекулярной и ионной форм индикатора, которые меняются в процессе титрования, т.к. меняется рН раствора, и, следовательно, существует такое значение рН, при которой индикатор наиболее резко меняет свою окраску:
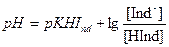 ( 4 .4)
( 4 .4)
Визуально изменение окраски раствора заметно, когда концентрация одной окрашенной формы примерно в 10 раз превышает концентрацию другой.
В соответствии с принципом Ле-Шателье в кислой среде будет преобладать форма HInd (кислотная, молекулярная форма индикатора), и окраска раствора будет определяться окраской данной формы.
Иными словами, когда отношение
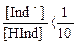 ,
,
то окраска раствора соответствует окраске молекулярной форме индикатора.
При добавлении щелочи концентрация диссоциированной (ионной) формы индикатора будет увеличиваться, и при соотношении:
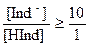 ,
,
окраска раствора будет соответствовать окраске преобладающей ионной формы индикатора.
Если концентрация ионов Н+ в растворе достигнет величины константы диссоциации индикатора [H+] = KHInd,
то 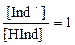 и [Ind-] = [HInd],
и [Ind-] = [HInd],
и в этом случае раствор будет иметь смешанную или промежуточную окраску, которая воспринимается в интервале соотношения 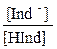 от 0,1 до 10.
от 0,1 до 10.
Верхний и нижний пределы величины рН, при которых индикатор будет заметно изменять свою окраску, составляют соответственно:
рН = рКHInd + lg10 = рКHInd + 1,
рН = рКHInd + lg10-1 = рКHInd – 1;
следовательно, получают интервал перехода окраски индикатора:
∆рН = рКHInd 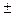 1 (4.5)
1 (4.5)
То значение рН, при котором кислотно-основный индикатор наиболее резко меняет свою окраску, называется показателем титрования рТ индикатора.
В процессе титрования в тот момент, когда наблюдается наиболее резкое изменение окраски раствора от добавленной одной избыточной капли стандартного раствора реагента, титрование следует закончить.
При проведении кислотно-основного титрования индикатор подбирают таким образом, чтобы значение показателя титрования индикатора рТ находилось как можно ближе к значению рН точки эквивалентности в каждом конкретном случае.
В таблице 2 представлены некоторые кислотно-основные индикаторы и их характеристики.
Таблица 2 – Важнейшие кислотно-основные индикаторы
| Индикатор | рК | рТ | Интервал перехода окраски индикатора | Цвет | |
| кислотная форма | основная форма | ||||
| Метиловый желтый | 3,1 | 3,0 | 2,9 – 4,0 | красный | желтый |
| Метиловый оранжевый | 3,5 | 4,0 | 3,1 – 4,0 | красный | желтый |
| Метиловый красный | 5,0 | 5,5 | 4,2 – 6,2 | красный | желтый |
| Бромтимоловый синий | 7,1 | 7,0 | 6,0 – 7,0 | желтый | синий |
| Фенолфталеин | 8,7 | 8,0 | 8,2 – 10,0 | бесцветный | пурпурный |
Лабораторная работа №2.
2.1 Алкалиметрическое определение серной кислоты в растворе с индикаторами фенолфталеином и метилоранжем.
Цель работы : методом алкалиметрического титрования определить все виды объемных концентраций и массу серной кислоты в исследуемом растворе с использованием в качестве индикаторов фенолфталеина (ф/ф) и метилоранжа (м/о).
В результате выполнения данной лабораторной работы студент должен:
– усвоить теоретические основы метода кислотно-основного титрования;
– усвоить принцип выбора индикатора, его действие при титровании;
– приобрести навыки безупречного владения приемами титрования;
– применять закон эквивалентов при обработке результатов эксперимента;
– осмысленно систематизировать полученные экспериментальные данные, оформить их в виде протокола и сделать правильные выводы в соответствии с поставленными задачами.
Оборудование и реактивы: прибор для титрования, стаканы химические различной вместимости, мерная колба вместимостью 100 см3 (задача), пипетка (10 см3), мерные цилиндры, колбы конические вместимостью 250 см3 для титрования (по 2 шт), воронка, груша резиновая, концентрированный раствор серной кислоты (задача), стандартный водный раствор щелочи с молярной концентрацией эквивалента вещества 0,1 моль/дм3, растворы индикаторов фенолфталеина и метилоранжа, дистиллированная вода.
Титриметрическая реакция
| H2SO4 | + | 2NaOH | = | Na2SO4 | + | 2H2O |
| z = 2 | z = 1 |
в точке эквивалентности, согласно формуле (4.1), выполняется закон эквивалентов: