Классификация методов объемного анализа.
Метод нейтрализации. Индикаторы в методе нейтрализации .
Данная группа методов основана на измерении точного объема стандартного раствора реагента, затраченного на реакцию с определенным объемом (аликвотной частью) исследуемого раствора, содержащего определяемое вещество.
Раствор реагента с точно известной молярной концентрацией эквивалента называется стандартным раствором реагента, рабочим раствором или титрантом.
Процесс титрования состоит в следующем: к аликвотной части исследуемого раствора (коническая колба для титрования) прибавляют из бюретки медленно, небольшими порциями, по каплям, стандартный раствор реагента при постоянном перемешивании. Точку конца титрования (ТКТ) устанавливают при помощи индикатора – вспомогательного вещества, которое добавляют в исследуемый раствор и в присутствии которого проводят титрование. В точке конца титрования индикатор и, следовательно, раствор должны резко поменять свою окраску.
Особенности метода объемного анализа:
а) достаточная скорость выполнения анализа и получения конечного результата;
б) широкая возможность использования различных типов химических реакций, положенных в основу титрования:
– нейтрализации;
– окисления-восстановления;
– комплексообразования;
– осаждения.
Требования, предъявляемые к химическим реакциям в объемном анализе:
1) взаимодействие между определяемым веществом и реагентом должно протекать в определенных стехиометрических отношениях;
2) отсутствие побочных взаимодействий в анализируемом растворе; отсутствие мешающих ионов, способных взаимодействовать с данным реагентом;
3) реакция определяемого иона с реагентом должна протекать с достаточно большой скоростью, в противном случае метод прямого титрования неприменим – используют метод непрямого титрования (обратного; титрования заместителя);
4) наличие и возможность использования подходящего индикатора для определения точки конца титрования.
При проведении титрования к известному объему раствора (аликвотной части) определяемого вещества малыми порциями (по каплям) добавляют раствор реагента с точно известной молярной концентрацией эквивалента – стандартный раствор – до тех пор, пока его количество не станет эквивалентно количеству определяемого вещества, содержащегося в аликвотной части исследуемого раствора – до точки конца титрования.
Момент, когда количество реагента, содержащегося в расходованном на титрование объеме стандартного раствора, эквивалентно количеству определяемого вещества, содержащегося в аликвотной части титруемого раствора, называется точкой эквивалентности или теоретической точкой конца титрования.
Точка конца титрования, фиксируемая при помощи индикатора, теоретически может не совпадать с точкой эквивалентности. Задача правильного выбора индикатора состоит в том, чтобы различие между точкой конца титрования и точкой эквивалентности было минимальным. Изменение окраски индикатора должно быть резким и происходить от одной избыточной капли прибавленного рабочего раствора реагента. Прибавление следующей капли рабочего раствора реагента не должно сказаться на окраске индикатора.
Классификация методов объемного анализа.
В зависимости от типа химической реакции, лежащей в основе титрования, различают следующие методы объемного анализа:
а) метод нейтрализации – в качестве стандартных растворов используют растворы сильных кислот и оснований (щелочей) – метод ацидиметрического или алкалиметрического титрования соответственно;
б) метод окисления – восстановления – в качестве стандартных используют растворы окислителей и/или восстановителей; методы окислительно-восстановительного титрования называют по названию реагента: метод перманганатометрии, в котором стандартным раствором реагента является раствор перманганата калия; дихроматометрии – стандартный раствор дихромата калия и др.;
в) метод осаждения;
г) метод комплексообразования, частным случаем которого является метод комплексонометрии.
По способу выполнения титрования различают методы прямого и обратного титрования, а также метод титрования заместителя:
a) метод прямого титрования состоит в непосредственном титровании аликвотной части исследуемого раствора, содержащего определяемый ион, стандартным раствором реагента. Например, титрование сильных кислот, щелочей, гидролизующихся солей (карбоната натрия) в присутствии кислотно-основных индикаторов; титрование соли железа (II) раствором перманганата калия и др. В точке конца титрования выполняется закон эквивалентов, который лежит в основе всех расчетов: определяемое вещество (ион), содержащееся в аликвотной части, и реагент, содержащийся в израсходованном на титрование объеме стандартного раствора, прореагировали в количествах, равных количествам веществ их эквивалентов:
Математическое выражение закона эквивалентов:
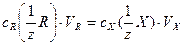 (4.1)
(4.1)
где 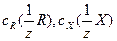 - молярные концентрации эквивалентов стандартного раствора реагента и определяемого вещества Х, [моль/дм3]; VR – объем стандартного раствора реагента, израсходованного на титрование (бюретка), [см3]; V х – аликвотная часть исследуемого раствора, [см3].
- молярные концентрации эквивалентов стандартного раствора реагента и определяемого вещества Х, [моль/дм3]; VR – объем стандартного раствора реагента, израсходованного на титрование (бюретка), [см3]; V х – аликвотная часть исследуемого раствора, [см3].
б) метод обратного титрования используется:
– когда вещество, содержание которого следует определить, реагирует с реагентом стандартного раствора, однако реакция при этом не сопровождается резким изменением концентрации в точке эквивалентности;
– когда реакция протекает медленно;
– когда не удается подобрать индикатор, резко меняющего свою окраску в точке конца титрования;
– когда определяемое вещество является летучим.
Суть метода обратного титрования сводится к следующему: к аликвотной части исследуемого раствора приливают заведомо известный избыток (точно измеренный объем) одного из стандартных растворов, затем непрореагировавшую его часть титруют стандартным раствором другого реагента.
Например, определение содержания карбоната кальция в известняке выполняют методом ацидиметрического титрования. При этом реакция углекислого кальция с соляной кислотой при постепенном ее прибавлении (в процессе прямого титрования) протекает медленно, поэтому прямое титрование в данном случае неприемлемо. Используют метод обратного титрования: к навеске карбоната кальция прибавляют заведомый избыток стандартного раствора соляной кислоты, нагревают до полного растворения навески карбоната кальция, а затем титруют оставшуюся, непрореагировавшую часть (избыток) соляной кислоты стандартным раствором щелочи. Зная общее количество взятой для анализа соляной кислоты и ее остаток, находят количество кислоты, затраченное на реакцию с карбонатом кальция.
Другой пример. Для определения содержания иона аммония в аммонийных солях исследуемый раствор обрабатывают заведомым избытком стандартного раствора щелочи и кипятят для удаления аммиака. Затем остаток щелочи титруют стандартным раствором соляной кислоты.
Расчеты при использовании метода обратного титрования выполняют по формуле:
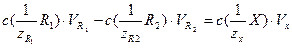 (4.2)
(4.2)
где 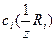 – молярная концентрация эквивалентов первого стандартного раствора реагента (раствор щелочи), [моль/дм3]; VR 1 – объем первого стандартного раствор; VR 2 , V х – объем стандартного раствора соляной кислоты и раствора определяемого вещества соответственно, [см3].
– молярная концентрация эквивалентов первого стандартного раствора реагента (раствор щелочи), [моль/дм3]; VR 1 – объем первого стандартного раствор; VR 2 , V х – объем стандартного раствора соляной кислоты и раствора определяемого вещества соответственно, [см3].
в) титрование заместителя. Этот метод используется тогда, когда невозможно применить методы прямого или обратного титрования. В этих случаях определяемый ион при помощи стехиометрической химической реакции переводят в такое химическое соединение, которое можно непосредственно титровать стандартным раствором реагента. В качестве примера можно привести йодометрическое определение меди.








