2.1. Расчет необходимого объема исходного концентрированного раствора.
Составляют уравнение материального баланса по массе раствора и по массе растворенного вещества:
| I (концентрированный раствор) | II (Н2О) | III (заданный раствор) | |||
| ωх | ω | 0 | ωз | ||
| Vх | V(H2O) | Vз | |||
| ρх | ρ(Н2О) | ρз | |||
| 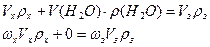
| где V з ρз = m р-ра = 100 г
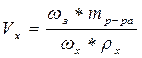
|
Полученное значение Vx [см3] округляют до десятых после запятой.
Затем находят V(Н2О), используя уравнение закона сохранения для массы раствора:
V (Н2О) = mр-ра – ρх Vx,
Полученное значение округляют до целого числа.
3. Приготовление раствора с заданной массовой долей.
3.1. При помощи чистой пипетки или бюретки, предварительно промытых небольшим количеством концентрированного раствора, отмеряют рассчитанный его объем и переносят в чисто вымытую дистиллированной водой колбу. Сюда же приливают при помощи мерного цилиндра рассчитанный объем дистиллированной воды, тщательно перемешивают.
3.2.Приготовленный таким образом раствор должен соответствовать заданному раствору, иметь заданную массовую долю поваренной соли в растворе.
Правильность приготовления раствора проверяют, измеряя его плотность (метод денсиметрии).
Для этого чистый цилиндр ополаскивают 3–5 см3 приготовленного раствора, после чего наливают в него достаточный (для свободного перемещения ареометра) объем раствора и погружают в него ареометр с подходящей шкалой.
3.3. По измеренной плотности, пользуясь справочной таблицей 1, определяют массовую долю вещества в растворе. При расчете массовой доли используют метод интерполяции.
3.4. Определяют погрешность эксперимента:
Δω = ωзаданное – ωполученное
Допустимая погрешность ± 0,2%.
4. Составляют отчет по выполненной работе в соответствии с требованиями по составлению отчета.
Дополнительное задание
Рассчитать для приготовленного раствора NaCl
а) молярную концентрацию с( NaCl) [моль/дм3];
б) моляльную концентрацию b ( NaCl ) [моль/кг];
в) массовую концентрацию ρ ( NaCl ) [г/дм3];
г) титр Т NaCl [г/ см3];
д) молярные доли соли χ (NaCl).и воды χ (Н2О) в растворе .
Задачи для самостоятельного решения
Решение задач 1-7 приложить к отчету.
1. Чему равна молярная концентрация эквивалента (нормальная концентрация) 0.25 М раствора Na2СO3, используемого для получения NaCl и СО2?
(Ответ: 0.5 н)
2. В плазме крови содержится 2.5 ммоль/дм3 кальция. Считая, что ионы кальция находятся только в виде кальция хлорида, вычислите массовую долю (ω (СаСl2) в мг%) в плазме крови. Плотность плазмы крови ρ составляет 1.03 г/см3.
(Ответ: ω=2.69 мг%)
3. Рассчитайте в %, мг % и мкг % массовую долю и моляльность децимолярного раствора аммиака (М=17 г/моль, ρ=1.0 г/см3)
(Ответ: ω=0.17 %=170 мг %=1.7·105 мкг %, b=0.099 моль/кг)
4. Массовая доля калия в крови в расчете на элемент составляет 20 мг%. Вычислите массу калия, содержащегося в виде ионов в 3.0 кг крови?
(Ответ: m=0.6 г)
5. Рассчитайте молярную концентрацию, мольную долю и титр глюкозы в ее 5% -ном растворе (М = 180 г/моль). Плотность раствора ρ = 1.02 г/см3.
(Ответ: с = 0.283 М, χ = 00524, Т= 0.051 г/мл)
6. Растворимость СО2 в Н2О при 0 °С и давлении 1.0133 105 Па равна 1.713 м3 на 1 м3 Н20. Какова масса и массовая доля CO2 в этом растворе?
(Ответ: m = 3.365 кг, ω = 0.335)
7. Какой объем аммиака (н.у.) нужно растворить в 80 см3 воды для получения нашатырного спирта? Раствор аммиака с ω (NH3) = 10% и ρ = 0,959 г/см3 называют нашатырным спиртом.
(Ответ: 11,7 дм3)
4. Тема 2 . Введение в объемный (титриметрический) анализ.








