Приготовление разбавленного раствора хлорида натрия из его концентрированного раствора путем разбавления.
Контроль состава раствора методом денсиметрии
В результате выполнения данной работы студент должен:
– усвоить понятия: раствор, растворитель, растворенное вещество;
– знать особенности структуры воды в жидком и твердом состояниях;
– иметь понятия о растворимости твердых веществ, газов в воде;
– знать факторы, влияющие на растворимость;
– знать способы выражения состава растворов, уравнения связи между различными способами выражения состава раствора;
– знать, что приготовить раствор можно различными способами:
а) по растворению точной навески сухого вещества, кристаллогидрата; путем поглощения определенного объема газа жидкостью;
б) из концентрированного раствора путем его разбавления;
в) из разбавленного раствора путем его концентрирования или упаривания, если растворенное вещество – нелетучее;
г) из фиксанала.
Уметь использовать фактический материал для решения расчетных и экспериментальных задач.
Цель работы: приготовление разбавленного раствора хлорида натрия из его концентрированного раствора путем разбавления.
Получить индивидуальное задание у преподавателя, внести его в рабочую тетрадь – заданный разбавленный раствор.
Для приготовления разбавленного раствора с заданной массовой долей растворенного вещества из его концентрированного раствора необходимо:
– знать точную концентрацию исходного концентрированного раствора;
– уметь рассчитать необходимый его объем для приготовления заданного раствора;
– уметь рассчитать необходимый для разбавления объем воды;
– приготовить заданный раствор, используя соответствующую, наиболее подходящую посуду (пипетки; бюретки; мерные колбы – для точных измерений объемов жидкостей – точность 0,2%; мерные цилиндры; мензурки – точность 2–5%);
– уметь измерять плотность раствора при помощи ареометра;
– уметь использовать метод интерполяции .
Оборудование и реактивы: набор ареометров; мерный цилиндр вместимостью 100 см3, пипетка на 10 см3, бюретка на 25 см3, груша резиновая, концентрированный раствор хлорида натрия, дистиллированная вода (1 см3 = 1 мл), стаканы химические различной вместимости.
Последовательность выполнения работы:
1. Определение массовой доли NaCl [%] в исходном концентрированном растворе по его плотности, измеренной ареометром.
Ареометр – стеклянная трубка с расширением внизу, частично заполненная дробью (ртутью). В верхней узкой части – шкала с делениями. Наименьшее значение плотности ρ (г/ см3) нанесено вверху шкалы, наибольшее – внизу. Применение ареометра основано на том, что плавающее тело погружается в жидкость до тех пор, пока масса вытесненной им жидкости не станет равной массе самого тела. Глубина погружения ареометра зависит от природы жидкости: с уменьшением плотности жидкости ареометр погружается глубже.
1.1. Измерение плотности раствора выполняют следующим образом. Пустой чистый цилиндр ополаскивают 3 – 5 см3 раствора, затем наливают в него достаточное (для свободного перемещения ареометра) количество раствора, медленно погружают в раствор чистый сухой ареометр со шкалой плотностей, наиболее близкой ожидаемой плотности раствора. При этом тонкая часть ареометра придерживается двумя пальцами до тех пор, пока не будет ощущаться выталкивающая сила (всплывание). Уровень жидкости должен находиться в пределах шкалы ареометра. По нижнему уровню мениска раствора на шкале ареометра производится отсчет плотности. В случае если ареометр всплывает или уровень раствора не доходит до шкалы, следует использовать ареометр со шкалой, рассчитанной на большую плотность. Если ареометр тонет в растворе или уровень жидкости оказывается выше градуированной шкалы, следует воспользоваться ареометром, рассчитанным на меньшую плотность.
При использовании ареометра следует до и после употребления промыть его дистиллированной водой, осушить с помощью фильтровальной бумаги и поместить в специальный штатив.
1.2. По измеренной плотности, пользуясь данными справочной таблицы 1 плотностей растворов поваренной соли в зависимости от ее массовой доли в растворе, находят значение массовой доли соли в растворе.
Таблица 1 – Плотность водных растворов NaC l при 20 °С
| ω (NaC1), % | ρ, г/см3 | ω (NaC1), % | ρ, г/см3 | ω (NaC1), % | ρ, г/см3 |
| 0.00 | 1.000 | 5.50 | 1.038 | 11.00 | 1.078 |
| 0.50 | 1.003 | 6.00 | 1.041 | 11.50 | 1.082 |
| 1.00 | 1.005 | 6.50 | 1.045 | 12.00 | 1.086 |
| 1.50 | 1.009 | 7.00 | 1.049 | 12.50 | 1.089 |
| 2.00 | 1.013 | 7.50 | 1.053 | 13.00 | 1.093 |
| 2.50 | 1.017 | 8.00 | 1.056 | 13.50 | 1.097 |
| 3.00 | 1.020 | 8.50 | 1.060 | 14.00 | 1.101 |
| 3.50 | 1.024 | 9.00 | 1.063 | 14.50 | 1.105 |
| 4.00 | 1.027 | 9.50 | 1.067 | 15.00 | 1.109 |
| 4.50 | 1.031 | 10.00 | 1.071 | 15.50 | 1.113 |
| 5.00 | 1.034 | 10.50 | 1.074 | 16.00 | 1.116 |
Если показания ареометра не совпадают с табличными значениями, то массовую долю определяют методом интерполяции, суть которого сводится к определению промежуточного значения по двум крайним.
Допустим, при помощи ареометра определено значение плотности раствора соли ρх = 1,195 г/см3, что не соответствует табличным значениям плотностей. Крайние табличные значения плотностей по отношению к измеренному – ρ1 = 1,180 г/ см3 и ρ2 = 1,197 г/ см3. Им соответствуют массовые доли соли ω1=24% и ω2=26%. Считая, что в указанных пределах между плотностью и массовой долей раствора зависимость линейная (Рисунок 2), составляют пропорцию и рассчитывают массовую долю ωх приготовленного раствора:
ω2 - ω1 − ρ2 – ρ1
ωх - ω1 − ρх – ρ1
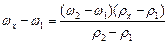 ,
,
откуда 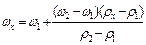
Таким образом, находят массовую долю соли в концентрированном растворе, равную ωх.
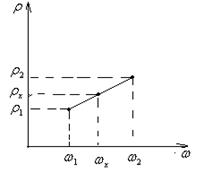
Рисунок 2 – Зависимость плотности раствора ρ от массовой доли соли ω.
2. Выполнение расчетов для приготовления раствора с заданной массовой долей (решение индивидуальной задачи).








