Не отожествлять с плотностью раствора!
Титр при известной молярной концентрации эквивалента вещества в растворе рассчитывают по формуле:
Т 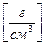 =
= 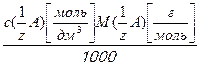 , (3.10)
, (3.10)
где М 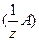 [г/моль] – молярная масса эквивалента вещества А.
[г/моль] – молярная масса эквивалента вещества А.
Масса вещества m [г] в определенном объеме раствора V р-р [дм3], молярная концентрация эквивалента вещества в растворе с 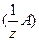 [моль/дм3] и молярная масса эквивалента М
[моль/дм3] и молярная масса эквивалента М 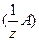 [г/моль] связаны соотношением:
[г/моль] связаны соотношением:
m [ г ] = с 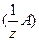
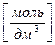 M
M 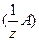
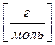 V р-р [дм3] (3.11)
V р-р [дм3] (3.11)
Удобным способом определения молярной концентрации эквивалента вещества в растворе при массовых анализах является использование титра стандарта по определяемому веществу.
Титр стандарта по определяемому веществу Тст/опр [г/см3] – равен массе [г] анализируемого вещества А, которая взаимодействует с 1 см3 стандартного раствора реагента R:
Т ст/опр 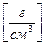 =
= 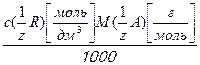 , (3.12)
, (3.12)
где с 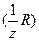 [моль/дм3] – молярная концентрация эквивалента реагента R (ст);
[моль/дм3] – молярная концентрация эквивалента реагента R (ст);
М 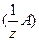 [г/моль] – молярная масса эквивалента определяемого вещества А (опр).
[г/моль] – молярная масса эквивалента определяемого вещества А (опр).
Зная титр стандарта по определяемому веществу легко вычислить молярную концентрацию эквивалента стандартного раствора реагента.
Моляльная концентрация b (А) [моль/кг] – отношение количества вещества А [моль] в растворе к массе растворителя В [кг]:
b(А) 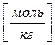 =
= 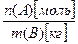 , (3.13)
, (3.13)
Например: b (H 2 SO 4) = 0,1 моль/кг – децимоляльный раствор серной кислоты – в одном килограмме растворителя (H2O) содержится 0,1 моль H 2 SO 4 .
Приготовление растворов
Растворы с точно известной молярной концентрацией эквивалента растворенного вещества называют стандартными растворами. Приготовить стандартный раствор можно одним из следующих способов:
а) по точной навеске вещества. Навеска – точно взвешенная масса вещества. Навеску вещества берут следующим образом: на аналитических весах взвешивают пустой бюкс, помещают в него вещество и взвешивают бюкс с веществом. Затем вещество переносят в мерную колбу и еще раз взвешивают пустой бюкс с остатками вещества. По разности находят точную массу вещества – это и есть навеска. Вместо бюкса в некоторых случаях можно использовать часовое стекло или кальку.
Для приготовления стандартного раствора определенную навеску вещества растворяют сначала в небольшом объеме воды (или другого растворителя), затем объем раствора в колбе доводят до метки водой или другим растворителем. Рассчитывают молярную концентрацию эквивалента вещества в растворе.
Приготовить стандартный раствор по точной навеске можно лишь для тех веществ, которые удовлетворяют следующим требованиям:
1) вещество является химически чистым;
2) состав вещества строго соответствует химической формуле;
3) вещество не взаимодействует с кислородом, углекислым газом воздуха, не поглощает влагу.
б) из фиксанала. Фиксанал представляет собой запаянную стеклянную ампулу, содержащую определенное количество вещества в сухом виде или в растворе, при приготовлении из которого 1 дм3 водного раствора молярная концентрация эквивалента вещества в растворе будет точно равна указанной на ампуле.
Изготовляют фиксаналы в специальных лабораториях. Для приготовления стандартного раствора ампулу разбивают определенным образом, содержимое ампулы количественно переносят в мерную колбу и разбавляют водой до метки. С учетом указанной на ампуле концентрации вещества и вместимости мерной колбы рассчитывают концентрацию полученного раствора.
Приготовление стандартного раствора из фиксанала используют в тех случаях, когда не представляется возможным взять точную навеску вещества, например, в полевой лаборатории, в геологической экспедиции, а также при выполнении экспресс-анализов.
в) по первичному стандарту. Рабочие растворы реагентов готовят сначала приблизительно заданной концентрации, а затем их титруют стандартными растворами соответствующих реагентов и по результатам титрования определяют точную концентрацию рабочих растворов. То вещество, которое используется для прямого или косвенного определения концентрации рабочего раствора реагента – стандартизации раствора, называется первичным стандартом. В качестве первичных стандартов рассматриваются только те вещества, которые удовлетворяют ряду важнейших требований:
1. Имеют самую высокую степень чистоты, и, более того, должны существовать доступные и надежные методы, подтверждающие их чистоту.
2. Являются химически устойчивыми к воздействию компонентов атмосферы.
3. Не содержат гидратную воду. Гидроскопичное или склонное к выветриванию вещество трудно высушить и взвесить.
4. Являются легкодоступными.
5. Имеют достаточно высокую молярную массу эквивалента. Чем выше эта масса, тем больше навеска вещества, требующегося для стандартизации или приготовления раствора заданной концентрации по точной навеске; ошибка взвешивания при этом уменьшается.
Число веществ, которые могут быть использованы в качестве первичных стандартов, ограничено. Чаще всего для стандартизации используют так называемые вторичные стандарты – вещества менее чистые, но имеющие постоянный химический состав.
ОБУЧАЮЩИЕ ЗАДАЧИ
Расчеты при приготовлении раствора заданного состава, его разбавлении, концентрировании, смешивании растворов одного и того же вещества объединяет одна общая идея – во всех случаях записывают уравнения материального баланса, связывающие характеристики конечного раствора и его исходных составляющих. В результате получают систему из двух алгебраических уравнений, решая которую, определяют искомые величины, необходимые для приготовления раствора с заданными характеристиками.
В расчетах с использованием массовой доли w (А) основу составляют два закона сохранения масс – относительно массы раствора (смеси) и относительно массы растворенного вещества, составленные на основе характеристик составных частей I и II, а также самого раствора (смеси):
1) баланс по массе раствора (смеси):
m р-ра ( I ) + m р-ра ( II ) = m (р-ра) (или m (смеси))
2) баланс по массе растворенного вещества А:
mA(I) + mA(II) = mA( р - р ) (или mA( смеси ))
Далее величины, представленные в этих уравнениях, выражают согласно условию задачи: через объемы, плотности и массовые доли растворенного вещества соответствующих растворов I и II (соответствующих компонентов I и II ) раствора.
Следует отметить, что закон сохранения объема при смешивании растворов в общем виде не выполняется, то есть объем смеси не всегда равен сумме объемов исходных растворов.
В расчетах с использованием молярной концентрации с(А) основу составляют закон сохранения количества растворенного вещества и приближенно выполняющийся закон сохранения объема раствора (смеси) в случае разбавления и смешения растворов. Последний выполняется тем точнее, чем более разбавлены смешиваемые растворы:
1) баланс по объему смеси при разбавлении и смешивании:
V р-ра ( I ) + V р-ра ( II ) = V (смеси)
2) баланс по количеству растворенного вещества:
n А (I) + n А (II) = n А ( смеси )
или сА( I ) V р-ра ( I ) + сА( II ) V р-ра ( II ) = сА(смесь) V (смесь)
Пример 1.
Какие количества составных частей I и II необходимо взять для приготовления 220 см3 раствора хлорида кальция с w (CaCl2)=8%, плотность раствора r =1,066 г/ см3.
Рассмотреть следующие способы приготовления раствора:
а) m (CaCl2)(тв) и V (H2O) – растворение CaCl2(тв) в воде;
б) m (CaCl2·6H2O) и V (H2O) – растворение кристаллогидрата CaCl2·6H2O в воде;
в) m (CaCl2)(тв) + V р-ра с w (СaCl2)=2% и r =1,015 г/см3 – концентрирование раствора;
г) V р-ра с w (СaCl2)=25% , r =1,228 г/см3 и V (Н2О) – разбавление концентрированного раствора;
д) V р-ра с w (СaCl2)=25% , r =1,228 г/см3 и V р-ра с w (СaCl2)=2% , r =1,015 г/см3 – смешивание двух растворов;
е) V р-ра с w (СaCl2)=2% и r =1,015 г/см3  концентрирование раствора путем упаривания растворителя.
концентрирование раствора путем упаривания растворителя.
Решение.
а) Составим два балансовых уравнения
1) по массе раствора:
m (CaCl2) + m (Н2О) = m (р-ра) = V· r
2) по массе растворенного вещества:
m (CaCl2) = V· r · w (СaCl2)
Подставляем данные из условия задачи и получаем систему двух уравнений:
m (CaCl2) + m (Н2О) = 220 см3·1,066 г/см3=234,52 г
m (CaCl2) = 220 см3·1,066 г/см3·0,08=18,76 г
Отсюда m (H2O)=234,52 г – 18,76 г = 215,76 г
Ответ: для приготовления раствора необходимо 18,76 г CaCl2(тв) и 215,76 см3 Н2О
(при условии, что r =1 г/см3).
б) Рассуждая подобным образом:
1) уравнение материального баланса по массе раствора:
m (CaCl2·6Н2О) + m (Н2О) = m (р-ра) = V· r
2) уравнение материального баланса по массе вещества CaCl2 в растворе:
m (CaCl2/ CaCl2· 6H2O) = V· r · w ( С aCl2),
где m ( CaCl 2 / CaCl 2 · 6 H 2 O ) = 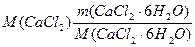 из соображения, что n (CaCl2) = n (CaCl2·6H2O)
из соображения, что n (CaCl2) = n (CaCl2·6H2O)
Система уравнений принимает вид:
m(CaCl2· 6H2O) + m(Н2О) = m(р-ра) = V· r
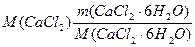 = V· r · w (СaCl2),
= V· r · w (СaCl2),
подставляем данные из условия задачи:
m (CaCl2· 6H2O) + m(Н2О) = 220 см3·1,066 г/см3 =234,52 г
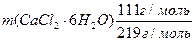 = 220 см3·1,066 г/см3·0,08 = 18,76 г
= 220 см3·1,066 г/см3·0,08 = 18,76 г
Отсюда m (CaCl2· 6H2O) = 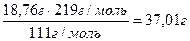
и m (H2O) = 234,52 г – 37,01 г = 197,51г
Ответ: для приготовления раствора необходимо 37,01 г CaCl2· 6H2O и 197,51 см3 H2O.
в) Составим два балансовых уравнения:
1) по массе раствора:
m (CaCl2) + m1 = mр-ра
или m (CaCl2) + V1 r 1 = V r
2) по массе растворенного вещества:
m (CaCl2) + m (CaCl2/исх.р-р) = m (CaCl2/конечн.р-р)
или m(CaCl2) + V1· r 1 · w 1 = V· r · w
Подставляем данные из условия задачи:
m (CaCl2) + V1·1,015 г/см3 = 220 см3·1,066 г/см3= 234,52 г
m (CaCl2) + V1·1,015 г/см3·0,02 = 220 см3·1,066 г/см3·0,08 =18,76 г
Решая систему двух уравнений методом вычитания из первого уравнения второго, получаем:
V1·1,015 г/см3·(1-0,02) = 234,52 г-18,76 г = 215,76 г
и V1 = 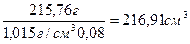
m (CaCl2) = 234,52 г-216,91 см3·1,015 г/см3 = 14,35 г
Ответ: для приготовления раствора нужно 14,35 г CaCl2 и 216,91 см3 исходного раствора с w (CaCl2)= 2% .
г) Составим два балансовых уравнения:
1) по массе раствора V1 · r 1 + m (H2O) = V· r
2) по массе растворенного вещества V1· r 1 · w 1 = V· r · w
получим систему: V1· r 1 + m (H2O) = V· r
V1· r 1 · w 1 = V· r · w
подставляем данные из условия задачи:
V1· 1,228 г/см3 + m(H2O) = 220 см3·1,066 г/ см3=234,52 г
V1 ·1,228 г/см3·0,25 = 220 см3·1,066 г/см3·0,08=18,76 г
Отсюда 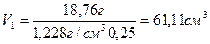 и
и
m (H2O)= 234,52 г – (61,11 см3 ∙1,228 г/см3)=159,48 г
Ответ: для приготовления раствора необходимо 61,11 см3 исходного раствора с w (CaCl2)=25% и 159,48 см3 H2O .
д) Составим два балансовых уравнения:
1) по массе раствора V1 r 1 + V2 r 2 = V· r
2) по массе растворенного вещества V1 · r 1 · w 1 + V2 · r 2 · w 2 = V· r · w
Подставляем данные из условия задачи:
V1 ·1,228 г/см3 +V2 ·1,015 г/см3= 220 см3·1,066 г/см3=234,52 г
V1 ·1,228 г/см3·0,25 + V2 ·1,015 г/см3·0,02 = 220 см3·1,066 г/см3·0,08=18,76 г
Решая систему двух уравнений с двумя неизвестными, находим V1=49,81 см3 и V2=170,79 см3.
Ответ: для приготовления смешанного раствора необходимо 49,81 см3 раствора с
w (CaCl2)=25% и 170,79 см3 раствора с w (CaCl2)=2%.
е) При выпаривании раствора масса растворенного нелетучего вещества не изменяется, а уменьшается лишь масса летучего растворителя - воды. Составим балансовое уравнение по массе растворенного вещества и определим объем исходного раствора, который необходимо взять для выпаривания:
m (CaCl2/до выпаривания)=m (CaCl2/после выпаривания)
или V1 · r 1 · w 1 = V· r · w,
откуда 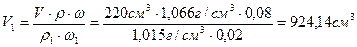
Определим массу воды, которую необходимо выпарить:
m(H2O)=m(исх.р-р) – m(конечн.р-р)=V1· r 1 -V· r = 924,14 см3·1,015 г/см3 – 220 см3·1,066 г/см3=703,48г.
Ответ: нужно взять 924,14 см3 раствора с w (CaCl2)=2% и 703,48 см3H2O.
Пример 2. Какие объемы газообразного аммиака (н.у.) и его раствора с w (NH3)=3% и плотностью r = 0,985 г/см3 необходимо взять для приготовления 100 см3 нашатырного спирта (раствор с w (NH3)=10% и r = 0,957г/см3).
Решение.
Запишем два уравнения материального баланса на основе двух составных частей смеси:
| I | II | III (конечный раствор) |
| NH3(газ) V ( NH 3 )=? (н.у.) | Раствор аммиака w 2 (NH3)=3% r 2 = 0,985 г/см3 V 2 =? | Раствор аммиака V (NH3)=100 см3 w (NH3)=10% r = 0,957 г/см3 |
Составляем уравнения материального баланса
1) по массе смеси 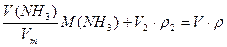
2) по массе аммиака 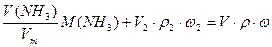 , где Vm = 22,4 дм3 /моль.
, где Vm = 22,4 дм3 /моль.
Подставив данные задачи, получим систему двух уравнений:
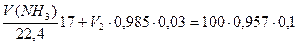
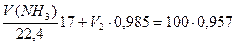
Решая систему из двух уравнений, находим необходимые объемы 3% раствора аммиака (V 2) и объема аммиака (газа): V(NH3)=8,9 дм3; V 2 = 90,3 см3
Ответ: для приготовления 100 см3 нашатырного спирта потребуется 90,3 см3 3% -ного раствора аммиака (r = 0,985 г/см3) и 8,9 дм3 (н.у) NH3
Пример 3. Какой объем раствора соляной кислоты с w (HCl)= 20% и r = 1,098 г/см3 необходим для приготовления одного литра 2М раствора?
Решение.
Исходный раствор HCl является более концентрированным, чем 2М раствор и приготовление последнего связано с разбавлением первого раствора водой. Поскольку при добавлении чистого растворителя содержание чистого вещества не меняется, то взятый для приготовления объем Vр-ра с w (HCl)=20% должен содержать такую же массу HCl, что и конечный разбавленный раствор:
m исх.р-р (HCl) =m конечн.р-р (HCl) или V· r · w ( HCl ) =c( HCl )·V·M(HCl) или
V ·1,098 г/см3 · 0,20 = 2 моль/дм3 ·1дм3·36,5 г/моль, тогда V = 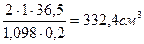 .
.
Ответ: объем раствора кислоты необходимый для приготовления 1 дм3 2М раствора HCl, равен 332,4 см3.
Методика приготовления 2М раствора: в мерную колбу на 1 дм3 вносят 332,4 см3 исходного раствора с w (HCl)=20% и затем разбавляют дистиллированной водой до метки на горлышке мерной колбы, до общего объема в 1 дм3.
Если при смешивании растворов некоторых веществ протекают химические реакции, то количества реагирующих веществ находят через заданные концентрации растворов. В этих случаях важно безукоризненно знать формулировку каждого способа выражения концентрации раствора, а также формулы (уравнения) связи между концентрациями, количеством растворенного вещества и его массой. Кроме того, следует обратить внимание на правильное определение качественного и количественного состава раствора после окончания химической реакции, а также правильное вычисление его массы:
1) количества n [моль] продуктов реакции определяет исходное вещество, взятое в недостатке, а исходное вещество, взятое в избытке, всегда присутствует в конечной смеси веществ в растворе;
2) масса конечной смеси (раствора) равна сумме масс составляющих ее исходных растворов и чистых веществ, из которой необходимо вычесть массы всех газообразных и малорастворимых продуктов реакции, которые покидают раствор (образование осадка; выделение газа);
3) объем конечной смеси приближенно равен сумме объемов исходных растворов, а при растворении твердых и газообразных веществ конечный объем раствора считается равным объему растворителя.
Для достаточно разбавленных растворов можно принять, что r р-р @ r (H2O)=1 г/см3.
Пример 4. В 250 г раствора фосфорной кислоты с w (H3PO4) = 9,8% растворили при нагревании 14,2 г оксида фосфора (V). Определить массовую долю растворенного вещества в конечном растворе.
Решение.
1) При растворении P2O5 в растворе фосфорной кислоты образуется дополнительное ее количество в результате химической реакции:
P2O5 + 3H2O (растворитель) ® 2H3PO4(р-р) ,
поэтому масса кислоты в конечном растворе равна:
m ( H 3 PO 4 )= m исх.р-р ( H 3 PO 4 ) + m ( H 3 PO 4 ).
Рассчитаем каждое слагаемое в отдельности:
m исх.р-р (H3PO4) =mр-р · w (H3PO4)=250г · 0,098 = 24,5г
m(H3PO4/по реакции)= n (H3PO4) М(H3PO4)= = 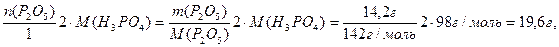
тогда mобщ(H3PO4)=24,5 г + 19,5 г = 44,0 г
2) Масса конечного раствора кислоты равна:
m(конечн.р-р)=m(исх.р-р) + m(P2O5)=250 г + 14,2 г = 264,2 г
и w конечн.р-р ( H3PO4))= 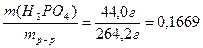 или 16,69% .
или 16,69% .
Ответ: массовая доля ортофосфорной кислоты в конечном растворе составила 16,69%.
Химическая посуда и правила ее использования
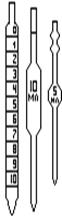
При выполнении практических работ для измерения объемов растворов используют различные виды мерной посуды: пипетки, бюретки, мензурки, мерные колбы (рисунок 1).
Пипетки служат для отбора и перенесения точного объема раствора из одного сосуда в другой. Они бывают двух типов – градуированные и простые (рисунок 1, а). Градуированные пипетки калиброваны, как и бюретки, однако измерения объема с их помощью менее точны, чем при использовании бюреток или простых пипеток. Поэтому аликвотные части раствора чаще отбирают простыми пипетками.
На простых пипетках имеется лишь одна метка, и они служат для отбора только одного (указанного на каждой пипетке) объема жидкости. Для заполнения пипетки один ее конец опускают в раствор, через другой при помощи резиновой груши всасывают жидкость, пока уровень ее не поднимется примерно на 2 см выше указанной на пипетке метки. Указательным пальцем быстро закрывают верхнее отверстие пипетки и, постепенно ослабляя нажим пальца, дают избытку раствора стечь. В тот же момент, когда нижний мениск коснется черты, снова плотно прижимают палец. Пипетку в слегка наклонном положении переносят в другой сосуд (при титровании – в коническую колбу – рисунок 1, г – или стаканчик; при разбавлении раствора – в мерную колбу и т.д.). Ни в коем случае не выдувают остатки жидкости из пипетки! Для достижения полноты вытекания жидкости из пипетки «носик» пипетки прислоняют к стенке сосуда, или, держа сосуд в наклонном положении, касаются несколько раз дна сосуда, давая жидкости свободно вытечь.
 а)
а)
|  б)
б)
|  в)
в)
|
 г)
г)
|  д)
д)
|  е)
е)
|
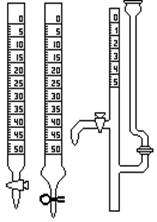
Рисунок 1 –Химическая посуда: а) пипетки; б) бюретки; в) мерные цилиндры (мензурки); г) колбы (коническая плоскодонная, круглая плоскодонная); д) мерные колбы; е) промывалка.
Бюретка представляет собой длинный цилиндрический градуированный сосуд с краном или другим затвором (рисунок 1, б). Бюретку используют для измерения точного объема стандартного раствора реагента, израсходованного при титровании на реакцию с определяемым веществом, содержащимся в аликвотной части анализируемого раствора, поэтому бюретку чаще всего заполняют раствором реагента с точно известной концентраций – стандартным раствором или титрантом. Процесс постепенного, непрерывно контролируемого добавления стандартного раствора реагента к аликвоте анализируемого раствора при постоянном перемешивании в присутствии индикатора или в его отсутствие называется титрованием. Во избежание ошибок при титровании необходимо следить, чтобы «носик» бюретки был полностью заполнен раствором и не содержал воздушных «пробок». Поэтому перед тем, как начать работать с бюреткой, следует проверить наличие воздуха в «носике» бюретки и устранить его. С помощью бюретки можно не только проводить титрование, но и отмерять с достаточной точностью определенные объемы растворов.
Мерный цилиндр или мензурка – это градуированный цилиндр или стакан, предназначенный для грубого измерения объемов различных жидкостей (рисунок 1, в).
Коническая плоскодонная колба используется для проведения титрования содержащейся в ней аликвотной части раствора определяемого вещества (рисунок 1,г).
Мерные колбы – это плоскодонные круглые колбы различной вместимости с длинным и узким горлом, на котором имеется кольцеобразная метка, ограничивающая обозначенный на колбе объем (рисунок 1, д). Их заполняют таким образом, чтобы нижний мениск жидкости точно совпадал с меткой на горлышке. Мерные колбы служат для разбавления растворов, для приготовления стандартных растворов по точной навеске сухого (твердого) вещества, для приготовления растворов из фиксаналов. Они не предназначены для хранения растворов: после приготовления растворы (особенно щелочные) следует перенести в чистые стеклянные бутыли, снабдить их соответствующими надписями.
Примечания:
1. Перед употреблением пипетки и бюретки промывают сначала дистиллированной водой, а затем ополаскивают соответствующим раствором для того, чтобы полностью удалить воду и тем самим избежать возможного разбавления раствора. С этой целью в бюретку набирают небольшую порцию того раствора, которым в последствии бюретку заполнят, и, вращая ее в горизонтальном положении, промывают стенки, после чего дают жидкости стечь через «носик».
Для ополаскивания пипетки небольшое количество исследуемого раствора наливают в чистый сухой стакан, при помощи резиновой груши засасывают в пипетку примерно на одну пятую объема, затем вращают, держа ее в горизонтальном положении. Содержимое бюретки или пипетки после ополаскивания сливают в раковину или сосуд для сбора отходов.
2. Сосуды для титрования (конические колбы) и мерные колбы промывают только дистиллированной водой.
Промывание и ополаскивание проводят несколько раз.
Лабораторная работа № 1.








