Способы выражения содержания растворенного вещества в растворе. Приготовление растворов: по точной навеске, из фиксанала.
Разбавление и концентрирование растворов .
Растворы – это гомогенные (однородные) системы, состоящие из двух и более компонентов и продуктов их взаимодействия, относительные количества которых могут изменяться в широких пределах. Химический состав и физические свойства всех частей раствора одинаковы.
Всякий раствор состоит из растворенного вещества (растворенных веществ) и растворителя – среды, в которой это вещество равномерно распределено в виде молекул и ионов. Растворителем обычно считается тот компонент, который в чистом виде существует в том же агрегатном состоянии, что и полученный раствор. Если оба компонента раствора до их смешивания находились в одинаковом агрегатном состоянии, то растворителем считается компонент, находящийся в большем количестве. Деление на растворитель и растворенное вещество является условным и применяется в основном для жидких растворов.
В химическом практикуме используются большей частью жидкие растворы, в которых растворителем является вода. Все биохимические и физико-химические процессы в живых организмах, большинства экосистем происходят в растворах, в водных средах. Лекарственные вещества эффективны лишь в растворенном состоянии. Изучение свойств водных растворов показывает, что их поведение подчиняется ряду законов, которые необходимо учитывать при решении практических задач.
Растворимость веществ зависит от их природы и свойств растворителя, температуры и давления (при растворении газа). Количественно растворимость характеризуется концентрацией насыщенного раствора при определенных температуре и давлении.
Раствор, содержащий наибольшее количество растворенного вещества, находящегося при данной температуре в присутствии нерастворившейся его части, называется насыщенным. Насыщенный раствор находится в динамическом равновесии между растворенным веществом и нерастворившейся его частью.
Раствор, который содержит меньшее количество растворенного вещества, чем в насыщенном растворе при тех же условиях, называется ненасыщенным.
Насыщенные растворы применяют сравнительно редко. В большинстве случаев используют ненасыщенные растворы, содержащие меньше растворенного вещества, чем его содержит при данной температуре насыщенный раствор. При этом растворы с малым содержанием растворенного вещества называются разбавленными, с высоким – концентрированными. Называя раствор разбавленным или концентрированным, характеризуют лишь сравнительные количественные характеристики раствора.
Количественно относительный состав раствора задается с помощью концентрации – характеристики раствора, определяющей пропорции, в которых смешаны растворенное вещество и растворитель. В общем случае концентрация – это относительное содержание вещества в растворе. Существуют массовые и объемные способы выражения концентрации раствора.
Обозначим: А – растворенное вещество, В – растворитель.
Массовой долей растворенного вещества w (А) называется отношение его массы m ( A ) к массе раствора m р-р:
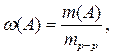

 (3.1)
(3.1)
где 0 < ω(А) < 1, а масса раствора может быть определена:
m р-р = m ( A ) + m ( B ) или
m р-р. = V р-р [см3] r р- р 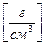 ,
,
где V р-р – объем раствора, [см3]; r р-р – его плотность, [г/см3].
Поскольку ω (А) + ω (В) = 1, то массовая доля растворителя может быть легко вычислена: ω ( B ) = 1 – ω ( A ).
Массы растворенного вещества А и растворителя В в растворе могут быть вычислены по формулам:
m ( A ) [г] = m р-р [г] × w (А) = V р-р. [см3] × r р-р [г/см3] × ω (А)
m ( B ) [г] = m р-р [г] – m ( A ) [г] = m р-р [г] × (1 – ω (А))
Допускается выражать массовую долю в долях единицы, в процентах (%), в промилле (‰– тысячная часть) и в миллионных долях (млн-1).
Молярная доля c (А) – это отношение количества моль вещества компонента А раствора к сумме чисел моль всех компонентов раствора, в частности, растворенного вещества (А) и растворителя (В):
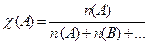 (3.2)
(3.2)
Молярная доля может быть безразмерной величиной (выражается в долях единицы):
0 < c < 1 или выражена в процентах.
Концентрации растворенного вещества в растворе, размерные величины:
Молярная концентрация растворенного вещества, с(А) [моль/дм3] – отношение количества растворенного вещества n (А) [моль] к объему раствора V р-р [дм3] – число моль растворенного вещества А, содержащееся в 1 дм3 раствора:
с(A) 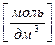 =
= 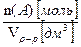 , (3.3)
, (3.3)
откуда n (А)[моль]=с(А)[ моль/ дм3] × V р-р [дм3] ,
и m ( A ) [г] = c ( A )[ моль/дм3]× V р-р [дм3] × M ( A ) 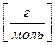 .
.
Примечание: в практических и методических разработках часто встречается и используется в этой связи термин «молярность» раствора. В этом случае для обозначения молярной концентрации используют символ М, который приводят после численного значения величины молярной концентрации, например, 1М – одномолярный раствор, что означает:
с (А) = 1 моль/дм3; 0,1М – децимолярный раствор–с (А) = 0,1 моль/дм3; 0,01М – сантимолярный раствор – с(А) = 0,01 моль/дм3. В современной химии для выражения молярной концентрации термин «молярность» не рекомендуется, однако допускается обозначение «М» (1М НСl – одномолярный раствор НСl).
Уравнения связи между массовой долей 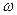 (A) вещества А в растворе и его молярной концентрацией с(А) [моль/дм3]:
(A) вещества А в растворе и его молярной концентрацией с(А) [моль/дм3]:
с(А ) 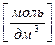 =
= 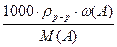 , (3.5)
, (3.5)
w(А) = 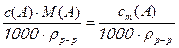 , (3.6)
, (3.6)
где с(А) – молярная концентрация вещества А [моль/дм3];
ρ р-р – плотность раствора, [г/см3];
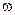 ( A ) – массовая доля вещества А (доли единицы);
( A ) – массовая доля вещества А (доли единицы);
М(А) – молярная масса вещества А [г/моль];
1000 – коэффициент пересчета размерностей.
При решении экспериментальных задач часто требуется определить массовую концентрацию растворенного вещества – ρ (А) [г/дм3], – масса растворенного вещества А [г; мг], содержащаяся в объеме раствора V [дм3]:
ρ (А) 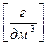 =
= 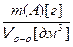 ,
,
которую легко рассчитать с учетом (3.3) :
ρ (А) [г/дм3] = с(А ) 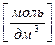 ∙ M ( A )
∙ M ( A ) 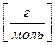 (3.4)
(3.4)
В справочниках растворимость твердых веществ выражают как массу [г] вещества А, растворенную полностью (количественно) в 100 г растворителя (Н2О) при температуре t° C [m( A)г 100г Н2О]; для газообразных веществ – объем газа [дм3], растворенного в 1 дм3 растворителя (Н2О) при температуре t ° C и давлении p[Па]. Например, растворимость хлорида калия в 100 г воды при 25 °С обозначается: S(KCl) = 36,0 (25 °С): при 25 °С в 100 г воды растворяется полностью, т.е., количественно, 36,0 г соли с образованием насыщенного раствора. На основе этих данных легко рассчитать массовую долю 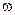 ( KCl) и молярную концентрацию с( KCl) [моль/дм3] в насыщенном растворе.
( KCl) и молярную концентрацию с( KCl) [моль/дм3] в насыщенном растворе.
Молярная концентрация эквивалента вещества А в растворе, с 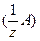 [моль/дм3] – отношение количества вещества эквивалента n (
[моль/дм3] – отношение количества вещества эквивалента n ( 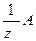 )[моль] к объему раствора V р-р [дм3], или число молей эквивалента вещества А в 1 дм3 раствора:
)[моль] к объему раствора V р-р [дм3], или число молей эквивалента вещества А в 1 дм3 раствора:
с 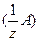
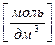 =
= 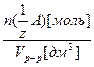 (3.7)
(3.7)
где 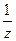 фактор эквивалентности вещества, z – число эквивалентности вещества.
фактор эквивалентности вещества, z – число эквивалентности вещества.
Химический эквивалент вещества – это его переменная характеристика, она зависит от конкретной реакции, в которой это вещество участвует; закон эквивалентов позволяет проводить расчеты без составления стехиометрического уравнения реакции, используя для этой цели лишь ее схему.
Химическим эквивалентом вещества А в данной реакции называется его молекула (формульная частица) А или ее условная часть – 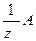 ,
,  которая в обменных реакциях равноценна одному однозарядному иону – присоединяет, высвобождает или обменивается одним однозарядным ионом (в частности, ионом Н+ или ОН–), а в окислительно-восстановительной реакции равноценна одному отданному (для восстановителя в полуреакции окисления) или одному принятому (для окислителя в полуреакции восстановления) электрону.
которая в обменных реакциях равноценна одному однозарядному иону – присоединяет, высвобождает или обменивается одним однозарядным ионом (в частности, ионом Н+ или ОН–), а в окислительно-восстановительной реакции равноценна одному отданному (для восстановителя в полуреакции окисления) или одному принятому (для окислителя в полуреакции восстановления) электрону.
Здесь число z - целое число, оно называется числом эквивалентности (z = 1, 2, 3…) и равно числу однозарядных ионов данной частицы, участвующих в данной обменной реакции или числу электронов соответственно для окислителя в полуреакции его восстановления или числу электронов восстановителя в полуреакции его окисления, а величина 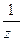 , принимающая значения
, принимающая значения 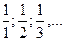 – называется фактором эквивалентности; она указывает, какая условная часть формульной частицы А соответствует ее эквиваленту в данной химической реакции.
– называется фактором эквивалентности; она указывает, какая условная часть формульной частицы А соответствует ее эквиваленту в данной химической реакции.
Обозначение химического эквивалента частиц сорта А: Э (А) = 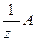 .
.
Смысл понятия «химический эквивалент» состоит в том, что для каждого из реагирующих веществ и продуктов данной химической реакции число эквивалентности z, как и сам эквивалент Э (А) = 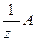 определяют относительно одного и того же эталона – однозарядного иона в обменных реакциях или электрона в окислительно-восстановительных, поэтому в данной химической реакции эквиваленты веществ будут равноценны друг другу. Это значит, что в реакцию вступают равные количества эквивалентов (числа молей – эквивалентов) реагентов и образуются в результате нее равные им количества (числа молей) эквивалентов продуктов – в этом суть закона эквивалентов.
определяют относительно одного и того же эталона – однозарядного иона в обменных реакциях или электрона в окислительно-восстановительных, поэтому в данной химической реакции эквиваленты веществ будут равноценны друг другу. Это значит, что в реакцию вступают равные количества эквивалентов (числа молей – эквивалентов) реагентов и образуются в результате нее равные им количества (числа молей) эквивалентов продуктов – в этом суть закона эквивалентов.
На основе заданной схемы реакции:
А + В → С + Д,
можно определить число эквивалентности z и фактор эквивалентности 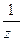 для каждого из участников реакции и далее записать символы их эквивалентов:
для каждого из участников реакции и далее записать символы их эквивалентов:
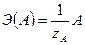 ,
, 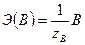 ,
, 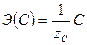 ,
, 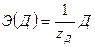 .
.
Закон эквивалентов: реагенты А и В реагируют друг с другом, а продукты С и Д образуются в результате химической реакции в равных количествах их эквивалентов:
n( 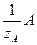 ) = n(
) = n( 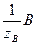 ) = n(
) = n( 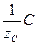 ) = n(
) = n( 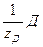 ) (1)
) (1)
Молярная масса эквивалента вещества А – M 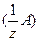
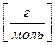 – это масса вещества, численно равна его эквиваленту; M
– это масса вещества, численно равна его эквиваленту; M 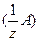
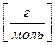 = М(А )
= М(А ) 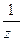 .
.
Молярный эквивалентный объем V(1/z А) [дм3/моль] – это объем газа А, занимаемый при нормальных условиях его эквивалентом.
Количество вещества эквивалента n( 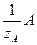 ) может быть вычислено:
) может быть вычислено:
n( 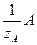 ) = m(А) / M
) = m(А) / M 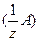
n( 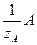 ) = V(A) / V(1/z A), если вещество А – газ, нормальные условия.
) = V(A) / V(1/z A), если вещество А – газ, нормальные условия.
Уравнение связи между молярной концентрацией эквивалента и молярной концентрацией вещества в растворе:
с 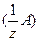
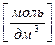 = z · с(А)
= z · с(А) 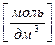 , (3.8)
, (3.8)
Примечание: в расчетных задачах, а также в химических источниках молярную концентрацию эквивалента называют «нормальной» концентрацией или «нормальностью» раствора. В этом случае для представления нормальной концентрации используют символ «н», который записывают после численного значения величины молярной концентрации эквивалента, например, 1н – однонормальный раствор, т.е., с 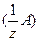 = 1 моль/дм3; 0,1н – децинормальный раствор, соответственно, с
= 1 моль/дм3; 0,1н – децинормальный раствор, соответственно, с 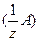 = 0,1 моль/дм3; 0,01н – сантинормальный раствор, с
= 0,1 моль/дм3; 0,01н – сантинормальный раствор, с 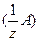 = 0,01 моль/дм3. Термины "нормальность" и "нормальная концентрация" не рекомендуются, однако допускается сокращенное обозначение: 1 н H2S04 или 0.5 н Н3РО4.
= 0,01 моль/дм3. Термины "нормальность" и "нормальная концентрация" не рекомендуются, однако допускается сокращенное обозначение: 1 н H2S04 или 0.5 н Н3РО4.
Молярная концентрация эквивалента наиболее широко используется в практике объемного химического анализа при обработке результатов эксперимента, при проведении расчетов по результатам титрования в объемном анализе, при решении экспериментальных задач, теоретической основой расчетов является закон эквивалентов.
Титр раствора Т [г/см3] – отношение массы растворенного вещества m [г] к объему раствора V р-р, [см3]:
Т 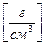 =
= 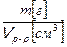 , (3.9)
, (3.9)
Титр раствора показывает массу растворенного вещества в 1 см3 раствора.








