Этерификация уксусной кислоты метанолом
 (4.12)
(4.12)
Алкоголиз йодистого метила
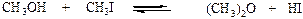 (4.13)
(4.13)
Описание работы реакционного узла
Лимитирующей стадией каталитического цикла является стадия окислительного присоединения CH3I к комплексу RhI, поэтому скорость процесса не зависит от концентрации исходных реагентов CH3OН и СО, а зависит от концентраций взаимодействующих на лимитирующей стадии частиц:
r = k [Kat][ CH3I]
Это означает, что скорость реакции не зависит от диффузных затруднений, связанных с переносом газообразного СО в жидкую реакционную массу (т.е. реакция протекает в кинетической области). Поэтому реактор может быть любой конструкции – аппарат с мешалкой, барботажная колонна, орошаемая колонна.
Первоначально данный процесс (разработанный компанией BASF) проводили в присутствии кобальтового катализатора, который требовал жестких условий: давление 500-750 атм., температура 200-230 оС. При этом выход уксусной кислоты на взятый метанол составлял: 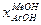 =85-90%.
=85-90%.
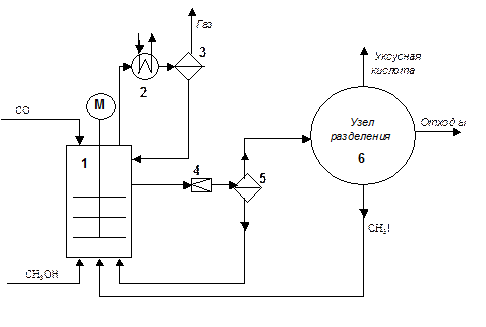
Рис.4.5. Схема реакционного узла производства уксусной кислоты карбонилированием метанола.
Разработанный позже (компанией Monsanto) родиевый катализатор оказался значительно более активным и селективным. Использование родиевого катализатора позволяет проводить реакцию уже при давлениях около 1 атм. и температурах до 150 оС. Однако, для повышения производительности, процесс осуществляют при давлении в 30-40 атм. и температурах 150-200 оС. При этом достигается выход 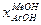 = 99 %.
= 99 %.
Схема реакционного узла представлена на Рисунке 4.5. Процесс осуществляют в непрерывном режиме. Реакция протекает в емкостном аппарате с мешалкой (1), в который подают свежий метанол, рециркулируемый раствор катализатора из сепаратора (5), рециркулируемый CH3I из узла разделения продуктов (6), и барботируют СО. Выделяемое в результате экзотермической реакции тепло снимается за счет кипения реакционной массы и конденсации паров в обратном холодильнике (2), и за счет охлаждения смеси при дросселировании через клапан (4). Выходящая из реактора смесь, частично испаряясь в дросселе (4), попадает в сепаратор (5), где пары отводятся в узел разделения (представляющий собой систему последовательных реактификационных колонн), а жидкая фаза из сепаратора (5), содержащая катализатор, возвращается в реактор.
Среда в реакторе представляет собой смесь продукта реакции - уксусной кислоты, с водой в соотношении (80-85):(15-20). Концентрация катализатора около 0.01%, концентрация йода около 1,2 моль/л.
Экономическая эффективность процесса определяется главным образом двумя факторами:
- минимизация потерь родия в рецикле, что, как видно из описания процесса, легко достигается;
- использованием дорогих коррозионностойких материалов для всех аппаратов схемы, так как уксуснокислая среда, содержащая сильную кислоту HI является очень агрессивной.
Актуальным направлением поиска способов интенсификации данного процесса является создание иммобилизованного родиевого катализатора. Существуют каталитические системы, обладающие высокой каталитической активностью, но их недостаточная стабильность не позволяет использовать их в промышленном масштабе.
4.4. CЕЛЕКТИВНОЕ ОКИСЛЕНИЕ ЭТИЛЕНА В АЦЕТАЛЬДЕГИД ( WACKER - PROCESS )
Вакер-процесс был первый промышленный процесс окисления с применением металлокомплексного катализа. Он был разработан в 1959 году в компании Wacker Consortium. Суммарное уравнение реакции выглядит так:
CH2=CH2 + 0,5 O2 à CH3CH=O (4.14)
Процесс был основан на известной до этого стехиометрической реакции окисления олефинов хлоридом палладия:
CH2=CH2 + PdCl2 + H2O à CH3CH=O + Pd0 + 2HCl (4.15)
Механизм протекания данной реакции описан в п. 3.3.5.2.2 (уравнение (3.50)). Промышленное значение эта реакция получила после того, как было установленно, что металлический палладий легко окисляется ионами Cu+2:
Pd0 + 2CuCl2 à PdCl2 + 2CuCl (4.16)
а ионы Cu+ легко окисляются кислородом до Cu+2:
2Cu+ + 0,5 O2 + 2H+ à Cu+2 + H2O (4.17)
Таким образом, каждая из стадий данного процесса не является каталитической, но при совмещении этих реакций в одном реакционном узле происходит восстановление исходной активной формы комплекса [PdCl4]-2 и соли CuCl2, поэтому процесс в целом соответствует признакам каталитического. Анионный комплекс [PdCl4]-2 устойчив в кислой среде, поэтому процесс проводят в водном растворе НCl.
Сырье и продукты
Промышленное применение данный процесс нашел только для производства ацетальдегида из этилена, так как при окислении других олефинов слишком высока доля побочных продуктов.
Побочные продукты.
При производстве ацетальдегида образуются следующие побочные продукты (указан выход относительно этилена):
- уксусная кислота (по реакции окисления ацетальдегида) – 2%;
- СО2 (по реакции полного окисления) - 1%;
- кротоновый альдегид (по реакции кислотно-каталитической самокондесации ацетальдегида) – 1%;
- хлорпроизводные (по реакции присоединения НCl по двойной связи) – 1%.
Выход ацетальдегида по этилену достигает 94-95 %.
Описание работы реакционного узла.
Существуют две технологии Вакер-процесса: двухстадийная и одностадийная. В обоих вариантах реакционная смесь представляет собой водный солянокислый раствор с рН = 0-2, содержанием хлорида палладия - 0,3-0,5 %, хлорида меди – 10-25 % (около 100 молей меди на 1 моль палладия).
Двухстадийная технология.
Схема реакционного узла представлена на Рисунке 4.6. Реактор (1) представляет собой орошаемую колонну с кислотостойкой насадкой, без теплообменных устройств. Тепло экзотермической реакции окисления отводится за счет испарения реакционной массы и подачи холодных реагентов. Температура процесса – 100-110 оС, давление около 10 атм. Реактор сверху орошают солянокислым раствором, содержащим полностью регенерированную каталитическую систему ([PdCl4]-2/CuCl2), поступающую из регенератора (2). Снизу в реактор барботируют этилен. В реакторе протекают реакции (4.15) и (4.16). Большой избыток меди по отношению к палладию, позволяет каждому атому палладия многократно совершить каталитический цикл за время пребывания в реакторе. В реакторе достигается практически полная конверсия этилена.
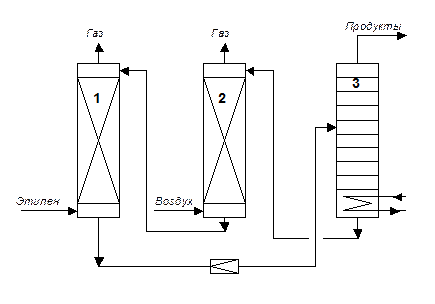
Рис. 4.6. Схема реакторного узла двухстадийной технологии окисления этилена до ацетальдегида.
Выходящая с низа реактора реакционная масса содержит практически полностью восстановленный хлорид меди (CuCl). Смесь попадает в ректификационную колонну (3), где сверху отгоняются продукты реакции, а водный раствор, содержащий соединения меди и палладия, из куба колонны направляется на орошение в регенератор (2). Регенератор представляет собой насадочную колонну, в низ которой подают воздух. В регенераторе протекает реакция окисления Cu1+ до Cu2+ по реакции (4.17), причем расход воздуха подобран так, чтобы конверсия кислорода была полной. Поэтому с верха регенератора отходит обескислороженный газ, который может быть использован в качестве технического азота. С низа регенератора выходит солянокислый раствор, содержащий полностью регенерированную каталитическую систему, который направляется на орошение реактора. Таким образом солянокислый раствор комплекса палладия циркулирует по трем аппаратам схемы (1, 3, 2).








