Влияние природы центрального атома на активность комплекса в реакции окислительного присоединения.
Активность металлов в данной реакции возрастает с увеличением основности центрального атома и его мягкости, как основания, т.е. с увеличением его электронно-донорных свойств. Например для реакции окислительного присоединения, сопровождающихся превращением электронного состояния центрального атома из d8 в d6 наблюдается следующая диаграмма активности:
Fe0 > CoI > NiII
^ ^ ^
Ru0 > RhI > PdII
^ ^ ^
Os0 > IrI > PtII
В рядах указанных атомов активность падает слева направо, т.к. основность уменьшается с увеличением заряда центрального атома. В столбцах активность возрастает сверху вниз, т.к. основность увеличивается вследствие увеличения диаметра атома.
Влияние электроно-донорных свойств лигандов на активность комплекса в реакции окислительного присоединения.
Электроно-донорные лиганды повышают электронную плотность на атоме металла и, тем самым, увеличивают реакционную способность комплекса в данных реакциях. И наоборот. Поэтому наблюдаются следующие ряды активностей некоторых лигандов:
PEt3 > PPh3
PРhMe2 > PPh3 > CO
I- > Br- > Cl-
Гомологическое присоединение является еще одним случаем окислительного присоединения. При гомологическом присоединении молекулы в ней тоже разрывается связь, но степень окисления металла в комплексе увеличивается на +1. Схематично механизм таких реакций отражает следующее уравнение:
2LmMn + XY à LmMn+1X + LmMn+1Y (3.16)
Противоречия с правилом Толмена здесь нет, так как вцелом в данной реакции общее число валентных электронов меняется на 2.
Промышленно-важной реакцией, протекающей по данному механизму является гомолитическое присоединение водорода к комплексу октакарбонила дикобальта:
[Co02(CO)8] + H2 ßà 2[HCo+1(CO)4] (3.17)
Окислительное сочетание - частный случай окислительного присоединения, характерный для олефиновых лигандов. В этой реакции разрываются p-связи лигандов, они соединяются s-связью между собой, образуя один бидентантный лиганд, а атом металла увеличивает степень окисления на +2. Примерами такого механизма служат следующие реакции:
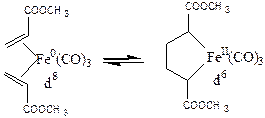 (3.18)
(3.18)
 (3.19)
(3.19)
Восстановительное элиминирование - это реакция обратная окислительному присоединению (обратная реакция (3.9)). Такие реакции являются, как правило завершающими в каталитическом цикле и приводят к образованию конечного или промежуточного продукта реакции.
В промышленности встречаются следующие реакции, относящиеся к этому типу:
Завершающая стадия каталитического цикла при гидрировании олефинов:
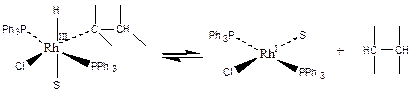 (3.20)
(3.20)
Образование альдегида при гидроформилировании олефинов:
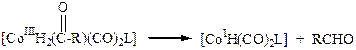 (3.21)
(3.21)
3.2.4. ВНЕДРЕНИЕ (по связи металл-лиганд)
Реакции внедрения протекают по следующей схеме:
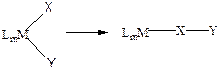 (3.22)
(3.22)
Реакцию внедрения лиганда Х по связи М-Y можно рассматривать, как внутрисферную нуклеофильную атаку Y- на активированную молекулу Х. Эта реакция характерна для следующих лигандов:
Y = H, C, N, O, Hal, металл
X = CO, олефины, диены, алкилы, нитрилы и т.п. (т.е. лиганды, имеющие кратные связи).
Реакция внедрения протекает через циклическое переходное состояние. Примерами реакций внедрения могут служить следующие:
- Внедрение олефинов по связи Pt-H:
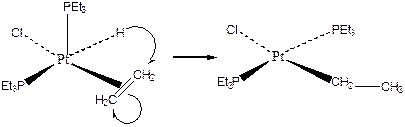 (3.23)
(3.23)
- Реакции внедрения олефинов по связи Ti-алкил
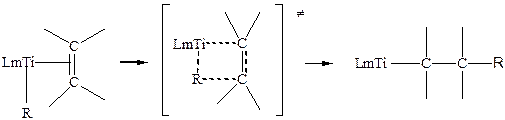 (3.24)
(3.24)
- Внедрение СO по связи металл-углерод:
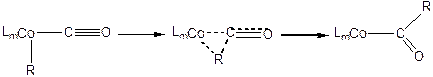 (3.25)
(3.25)








